Система учета научной деятельности (ASSA) |


|
Лаборатория эпигенетики развития (т.40)Отделение молекулярной генетики, клеточной биологии и биоинформатики
Научные результаты Сотрудники О Подразделении 1. Основное направление исследований
2. Задачи, решаемые в рамках основного направления на данном этапе:
Аннотация базового бюджетного проекта подразделения Бюджетный проект VI.60.2 «Индуцированные плюрипотентные стволовые клетки. Экспериментальное использование клеточных технологий для воспроизводства и коррекции патологических состояний» (координатор проекта: д.б.н. проф. С.М.Закиян). Цель проекта – создание клеточных моделей для моделирования и коррекции заболеваний человека, а также исследование статуса Х-хромосомы в индуцированных плюрипотентных стволовых клетках.
3. При наличии прикладных результатов (что желательно) должен быть введен еще один раздел «Прикладные разработки». Прикладных разработок нет.
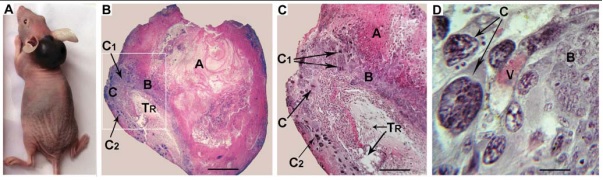
4. Иллюстрированное описание лучших результатов, полученных подразделением за последние 5 лет Впервые получены трофобластные стволовые (ТС) клеточные линии обыкновенной полевки в отсутствие фактора FGF4. Из бластоцист обыкновенной полевки M.rossiaemeridionalis с использованием полевочьего фактора LIF, ингибирующего дифференцировку, и питающего (фидерного) слоя клеток, в отсутствие фактора FGF4 были получены три независимые ТС клеточные линии. Полевочьи ТС клетки похожи на мышиные по морфологии, по экспрессии генов транскрипционных факторов, по способности при дифференцировке in vitro давать производные трофэктодермальной зародышевой линии, по способности инвазировать и разрушать ткани хозяина с образованием героррагических опухолей после инъекции ТС клеток мышам nude (рис.1). В полевочьих ТС клетках наблюдается импринтированная инактивация отцовской Х-хромосомы, что характерно для трофобластной зародышевой линии. Было показано, что у мыши фактор FGF4 и его рецептор FGFR2 являются эмбриональными сигнальными факторами, ответственными за поддержание недифференцированного состояния мультипотентных ТС клеток. Наши данные говорят о возможности существования другого сигнального пути, ответственного за установление и стабильную пролиферацию полевочьих ТС клеток.
Рисунок 1. Образование опухоли после инъекции ТС клеток полевки в мышь nude. (А) Общий вид опухоли. (B-D) Гистологические срезы гематомы. Окрашивание гематоксилином-эозином. (В) Поперечный срез центральной части гематомы через 35 дней после инъекции. (С) Увеличенное изображение отмеченного участка опухоли на рис.B; гистологический срез гематомы через кровеносный капилляр (D). (А) зона некроза, (В) пролиферирующие клетки, (С) гигантские клетки, (С1) дифференцирующиеся гигантские клетки, (C2) дегенерирующие гигантские клетки, (TR) ткани реципиента, (V) кровеносный сосуд.
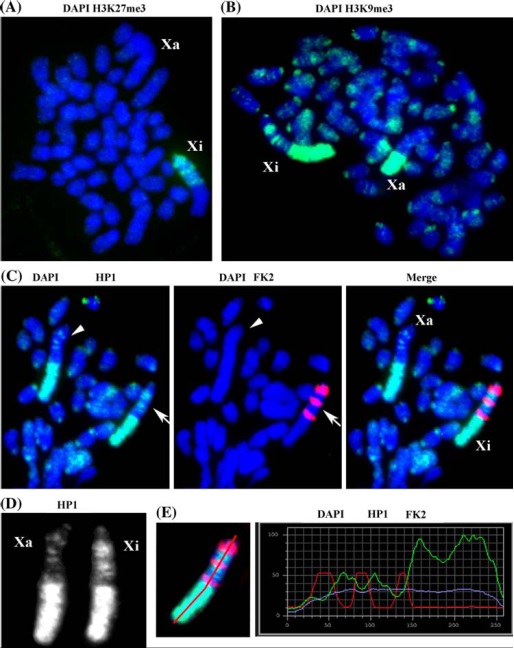
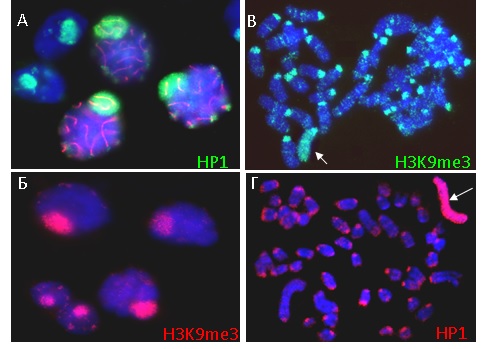
Изучено распределение модификаций хроматина на неактивной Х-хромосоме у обыкновенной полевки. Проведено сравнение распределения некоторых гистоновых модификаций на метафазных пластинках клеток экстраэмбриональной эндодермы и фибробластов полевки M.rossiaemeridionalis, которые являются примерами импринтированной и случайной инактивации Х-хромосомы. Х-хромосома M.rossiaemeridionalis несет большой блок конститутивного гетерохроматина, обогащенный повторяющейся ДНК, что делает данный вид хорошей моделью для изучения структуры хроматина. В фибробластах полевки и в большинстве клеток экстраэмбриональной эндодермы в молчание неактивной Х-хромосомы, по-видимому, включено два типа факультативного гетерохроматина (рис.2). Первый обогащен триметилированием H3K27 и убиквитинированием H2A и солокализуется с бэндингом Xist РНК, тогда как второй тип гетерохроматина связан с триметилированием H3K9 и гетерохроматиновым белком HP1. Блок конститутивного гетерохроматина на Х-хромосоме M.rossiaemeridionalis имеет такой же распределение модификаций, как и второй тип факультативного хроматина. Распределение гистоновых модификаций, белка HP1 и Xist РНК на неактивной Х-хромосоме полевки одинаково в случае импринтированной и случайной инактивации Х-хромосомы.
Рисунок 2. Два типа факультативного гетерохроматина на неактивной Х-хромосоме в XEN клетках M.rossiaemeridionalis.a H3K27me3 (зеленый). b H3K9me3 (зеленый). с HP1ß (зеленый) и FK2 (красный). Метафазные пластинки окрашены DAPI (синий). Активная (Xa) и неактивная (Xi) Х-хромосомы показаны головками стрелок и стрелками соответственно. d Распределение HP1ß на активной и неактивной хромосомах. e Увеличенное изображение неактивной Х-хромосомы с линейным сканированием интенсивности DAPI (синий), HP1ß (зеленый) и FK2 (красный).
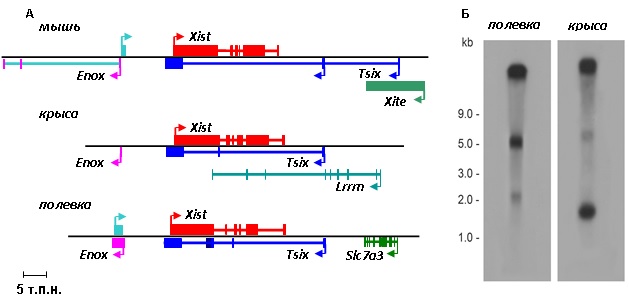
Обнаружено, что у грызунов основным репрессором гена Xist (ключевого гена процесса инактивации Х-хромосомы у самок млекопитающих) является транскрипция антисмыслового гена Tsix. Известно, что у мыши регуляция ключевого гена центра инактивации Xist, запускающего процесс инактивации Х-хромосомы, во многом зависит от транскрипции окружающих его некодирующих ядерных РНК Enox, Tsix, Xite (Lee et al., 1999, 2001, 2010). В данной работе восстановлена полная картина экзон-интронной структуры и границ транскриптов в ближайшем окружении гена Xist у полевки и крысы, и проведено сравнение с аналогичными данными, полученными на мыши (Рис. 3А). Установлено, что у полевок и крысы значительно изменены экзон-интронная структура, промоторные районы, точки старта и терминации транскрипции ядерной РНК Enox, а также отсутствует транскрипция, соответствующая регуляторному элементу Xite, которые у мыши играют важную роль в регуляции гена Xist. Показано, что основной промотор, структура и паттерн экспрессии гена Tsix консервативны у полевки, крысы и мыши, что позволяет предполагать его основную роль в регуляции гена Xist у грызунов. Показано, что большая часть РНК гена Tsix полевки и крысы, также как и у мыши, не подвергается сплайсингу (Рис. 3Б) и, вероятно, осуществляет репрессию гена Xist за счет транскрипции в районе его промотора.
Рисунок 3. (А) Экзон-интронная структура и границы некодирующих ядерных РНК (Enox, Xist, Tsix, Xite) и белок-кодирующих генов (Lrrrn, Slc7a3) в центре инактивации Х-хромосомы у грызунов: мыши, крысы и полевки. (Б) Нозерн-блот анализ паттерна экспрессии гена Tsix у тринадцатидневных эмбрионов полевки и крысы.
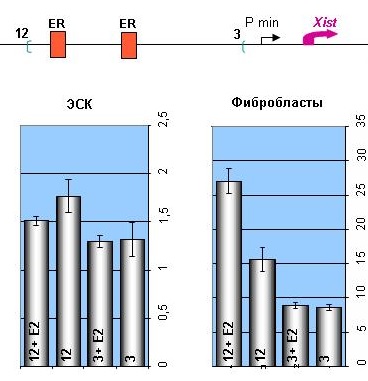
Впервые показано, что экспрессия гена Xist, инициирующего процесс инактивации Х-хромосомы у самок млекопитающих, находится под контролем гормона эстрогена. В промоторе гена Xist, обнаружены консервативные сайты связывания эстрогенового рецептора. В экспериментах с использованием люциферазных конструкций, содержащих промоторную область гена Xist мыши, показано, что при индукции эстрадиолом экспрессия репортерного гена статистически значимо усиливается в дифференцированных соматическим клетках и не изменяется в эмбриональных стволовых клетках (Рис.4). Полученные результаты позволяют заключить, что экспрессия гена Xist может находиться под влиянием эстрогена в момент запуска процесса инактивации.
Получены доказательства, что импринтированная инактивация Х-хромосомы у самок млекопитающих имеет происхождения от процесса мейотического сайленсинга половых хромосом в сперматогенезе. Показано, что у мыши и полевки неактивная структура Х-хромосомы на постмейотических стадиях развития в сперматогенезе самцов и на ранних этапах процесса импринтированной инактивации Х-хромосомы в эмбриогенезе самок обеспечивается.
Рисунок 4. Влияние эстрадиола (E2) на активность промотора гена Xist в эмбриональных стволовых клетках (ЭСК) и фибробластах. На схеме отмечены границы двух репортерных конструкций 12 и 3 (зелеными скобками), расположение консервативных сайтов рецептора эстрогена (ER), старта транскрипции гена Xist и района минимального промотора (P min). На гистограммах отражена относительная люциферазная активность репортерных конструкций 12 и 3 в эмбриональных стволовых клетках и фибробластах мыши, обработанных (+E2) и необработанных эстрадиолом.
Рисунок 5. Сходство модификаций хроматина, используемых при инактивации Х и Y-хромосом в мейотической инактивации (А, Б) и на ранних стадиях импринированной инактивации Х-хромосомы в TS-клетках мыши(В) и полевки (Г). HP1, H3K9me3 – модификации неактивного хроматина. Стрелкой показаны неактивные Х-хромосомы. Единой системой сайленсинга: HP1/3meH3K9. Единство спектра и паттерна модификаций хроматина на постмейотических стадиях сперматогенеза и на ранних этапах импринтированной инактивации Х-хромосомы свидетельствуют в пользу того, что половой хроматин в сперматогенезе и инактивация Х-хромосомы на ранних этапах импринтированной инактивации могут осуществляться за счет сходных механизмов, и подтверждает предположение о том, что мейотическая инактивация может представлять собой исходный механизм импринтированной инактивации Х-хромосомы.
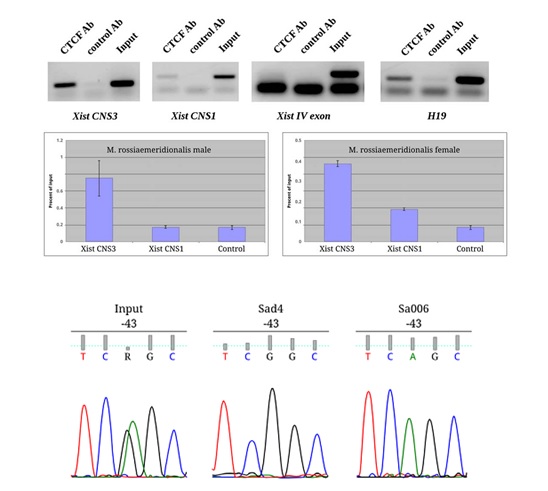
Впервые показано, что в репрессии гена Xist на активной Х-хромосоме принимает участие фактор CTCF, который связывается с его промоторной областью и играет роль инсулятора. В инактивации гена Xist на активной Х-хромосоме принимает участие фактор CTCF, который связывается с промоторной областью и играет роль инсулятора (рис.6). Консервативный сайт связывания фактора CTCF выявляется в 5' районе гена Xist у грызунов и человека, что свидетельствует об его функциональной значимости.
Рисунок 6. CTCF взаимодействует с промотором гена Xist на активной X-хромосоме.
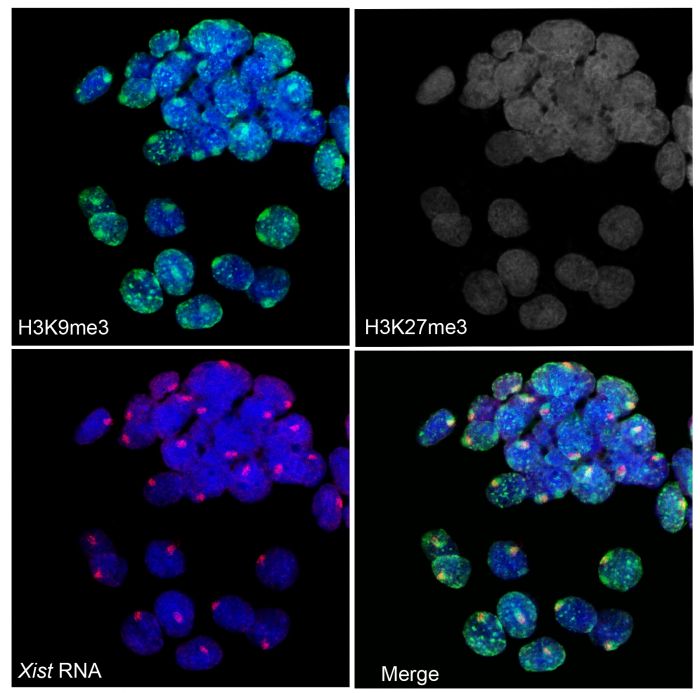
Показано, что механизмы и динамика процесса импринтированной инактивации Х-хромосомы в предымплантационном развитии у грызунов имеют значительные видоспецифические отличия. Обнаружены существенные отличия в составе и картине распределения репрессивных модификаций хроматина в процессе импринтированной инактивации Х-хромосомы у полевки и мыши (рис.9). Эти данные свидетельствуют о значительном разнообразии механизмов регуляции процесса импринтированной инактивации и свидетельствуют о различных потребностях в дозовой компенсации генов Х-хромосомы на ранних стадиях эмбрионального развития у грызунов.
Рисунок 7. Видоспецифические особенности хроматина неактивной Х-хромосомы при импринтированной инактивации на предимплантационных стадиях развития у полевки M. levis. Иммунофлуоресцентное окрашивание модификаций неактивного хроматина (H3K9me3 – зеленый и H3K27me3 - серый) совместно с РНК FISH (Xist РНК – красный) на стадии бластоцисты.
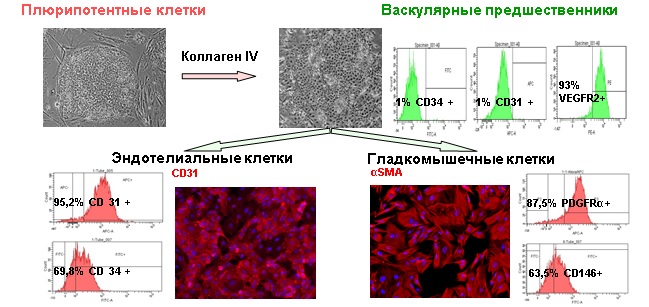
Разработан эффективный протокол направленной дифференцировки плюрипотентных стволовых клеток человека в предшественники васкулярных клеток. Для этого предложено проводить направленное получение васкулярных предшественников, дифференцируя плюрипотентные клетки в монослое на культуральной поверхности, обработанной коллагеном четвертого типа.
Рисунок 8. Направленная дифференцировка плюрипотентных клеток человека в предшественники васкулярных клеток и далее их дифференцировка в эндотелиальные и гладкомышечные клетки. Полученные дифференцированные производные экспрессируют характерные поверхностные (CD31, CD34, PDGFRα, CD146) антигены, выявляемые с помощью проточной цитофлуориметрии и флуоресцентного окрашивания.
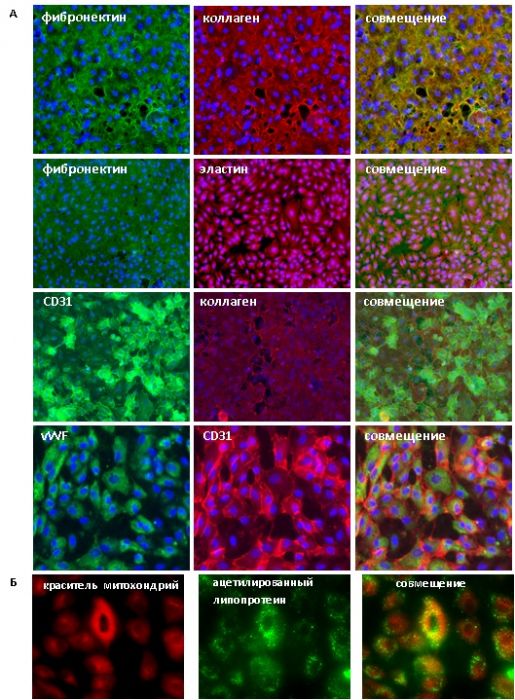
Рисунок 9. Оценка функциональности эндотелиальных клеток. Эндотелиальные клетки (CD31, vWF) нарабатывают компоненты внеклеточного матрикса: фибронектин, коллаген, эластин (А), и поглощают ацетилированную форму липопротеина низкой плотности (Б).
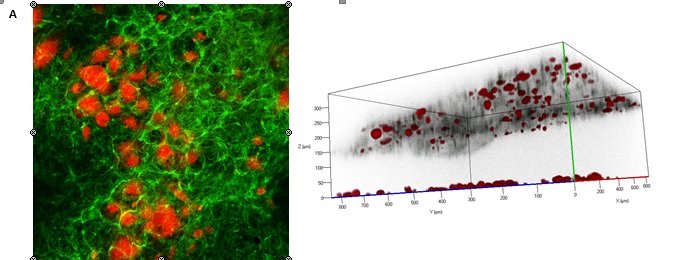
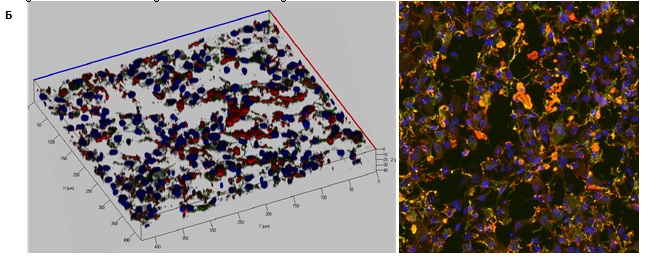
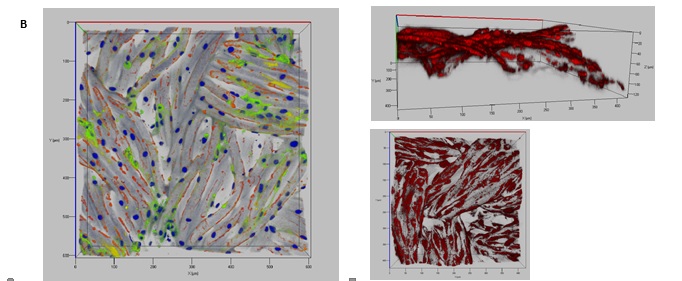
Рисунок 10. Пролиферация эндотелиальных клеток на различных типах матриксов, лазерная сканирующая конфокальная микроскопия. А – эндотелиальные клетки, меченные красителем митохондрий (красный), пролиферирующие на поверхности децеллюляризированого скэфолда сосуда человека (зеленый), окрашенного антителами к фибронектину; Б – эндотелиальные клетки на поверхности из поликапролактона, покрытого коллагеном 4 типа, окраска антителами к коллагену 1 типа (красный) и фибронектину (зеленый); В – эндотелиальные клетки на поверхности из лавсана, покрытого желатином, окраска антителами к CD31(зеленый), коллагену 1 типа (красный) и фибронектину (желтый), справа – распределение активно пролиферирующих клеток, окраска митохондриальным красителем TMRM (красный).
Разработка высокоэффективных технологий получения индуцированных плюрипотентных клеток (ИПСК) человека без генетической модификации геномов клеток. Показано, что полноценные ИПСК человека можно получить из фетальных нейральных стволовых клеток с помощью временной сверхэкспрессии гена OCT4 без интеграции плазмидной ДНК в геном клетки. Было обнаружено, что репрограммирование ФНСК, имеющих набор половых хромосом ХХ, не сопровождается эпигенетической реактивацией неактивной Х-хромосомы.
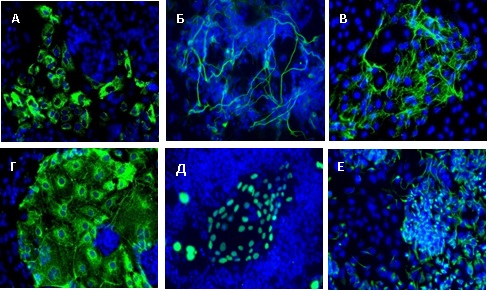
Рисунок 11. Иммуноцитохимический анализ клеток полученных в результате дифференцировки ИПСК in vitro. Синий цвет – окраска ядер клеток красителем DAPI, зеленый цвет - окраска клеток с помощью антител к коллагену I (А), β-III-тубулину (Б), фибронектину (В), цитокератину 18 (Г), транскрипционному фактору GATA6 (Д) и нестину (Е). Иммуноцитохимический анализ показал, что полученные в результате выполнения проекта ИПСК являются плюрипотентными, то есть, способны дифференцироваться в производные всех трех примитивных зародышевых листков.
5. Задачи, планируемые на перспективу:
Григорьева Елена Викторовна [старший научный сотрудник] Дементьева Елена Вячеславовна [старший научный сотрудник] Елисафенко Евгений Анатольевич [старший научный сотрудник] Малахова Анастасия Александровна [старший научный сотрудник] Медведев Сергей Петрович [ведущий научный сотрудник] Никитин Егор Романович [инженер] Павлова Софья Викторовна [научный сотрудник] Пекельник Нина Ивановна [старший лаборант] Сафонова Алёна Алексеевна [инженер] Сорогина Диана Александровна [инженер] Бывшие сотрудникиВагнер Татьяна ВладимировнаВалетдинова Камила Робертовна Васькова Евгения Андреевна Вершинин Александр Васильевич Демина Виктория Викторовна Жукова Ольга Андреевна Зайцева Наталья Сергеевна Захарова Ирина Сергеевна Камнев Антон Николаевич Ковлягина Ирина Сергеевна Колесников Николай Николаевич Мазурок Александр Борисович Мазурок Нина Алексеевна Маланханова Туяна Баировна Надточий Юлия Андреевна Немудрый Артем Александрович Нестерова Лидия Николаевна Павлова Марина Евгеньевна Перовский Петр Петрович Подвысоцкая Валерия Сергеевна Савушкина Дарья Антоновна Слободянюк Сергей Яковлевич Соболев Иван Андреевич Сорокин Михаил Алексеевич Сорокина Анастасия Евгеньевна Тарасова Аля Ивановна Устьянцева Елизавета Ивановна Уфимцева Елена Геннадьевна Хабарова Елена Александровна Шевченко Александр Игоревич Шерстюк Владимир Владимирович СовместителиАхмерова Валерия Игоревна [инженер]Выберите слайдером нужный промежуток, и список ниже будет содержать записи только нужного периода: 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Публикации Монографии Конференции Гранты Научное руководство Учебные курсы Патенты
|
| 2025 | Transgenic iPSC lines with genetically encoded MitoTimer to study mitochondrial biogenesis in dopaminergic neurons with tauopathy Nadtochy J.A., Medvedev S.P., Grigor’eva E.V., Pavlova S.V., Minina J.M., Chechushkov A.V., Malakhova A.A., Kovalenko L.V., Zakian S.M. Biomedicines, 2025, 13, 550 |
| 2024 | Cемейная гиперхолестеринемия: современные сведения и проблемы моделирования Захарова И.С., Шевченко А.И., Закиян С.М. Письма в Вавиловский журнал генетики и селекции, 2024, Т. 10. № 1. С.5-14 |
| iPSC-derived endothelial cells reveal LDLR dysfunction and dysregulated gene expression profiles in familial hypercholesterolemia Zakharova I.S., Shevchenko A.I., Arssan M.A., Sleptcov A.A., Nazarenko M.S., Zarubin A.A., Zheltysheva N.V., Shevchenko V.A., Tmoyan N.A., Saaya S.B., Ezhov M.V., Kukharchuk V.V., Parfyonova Ye.V., Zakian S.M. INT J MOL SCI, 2024, 25, 689. |
|
| IPSC-derived astrocytes contribute to in vitro modeling of Parkinson’s disease caused by the GBA1 N370S mutation Yarkova E.S., Grigor’eva E.V., Medvedev S.P., Pavlova S.V., Zakian S.M., Malakhova A.A. INT J MOL SCI, 2024, 25, 327 |
|
| A Knockout of Poly(ADP-Ribose) Polymerase 1 in a Human Cell Line: An Influence on Base Excision Repair Reactions in Cellular Extracts Khodyreva S.N., Ilina E.S., Dyrkheeva N.S., Kochetkova A.S., Yamskikh A.A., Maltseva E.A., Malakhova A.A., Medvedev S.P., Zakian S.M., Lavrik O.I. Cells, 2024, V.13(4):302 |
|
| Detection of ER stress in iPSC-derived neurons carrying the p.N370S mutation in the GBA1 gene Yarkova E.S., Grigor’eva E.V., Medvedev S.P., Tarasevich D.A., Pavlova S.V., Valetdinova K.R., Minina J.M., Zakian S.M., Malakhova A.A. Biomedicines, 2024, 12, 744. |
|
| Transcriptomic analysis of HEK293A cells with a CRISPR/Cas9-mediated TDP1 knockout Dyrkheeva N.S., Zakharenko A.L., Malakhova A.A., Okorokova L.S., Shtokalo D.N., Medvedev S.P., Tupikin A.A., Kabilov M.R., Lavrik O.I. BBA-GEN SUBJECTS, 2024, V. 1868(7). Article number 130616. |
|
| Generation of iPSCs from a patient with the M694V mutation in the MEFV gene associated with Familial Mediterranean fever and their differentiation into macrophages Grigor’eva E.V., Karapetyan L.V., Malakhova A.A., Medvedev S.P., Minina J.M., Hayrapetyan V.H., Vardanyan V.S., Zakian S.M., Arakelyan A., Zakharyan R. INT J MOL SCI, 2024, 25, 6102 |
|
| Generation of an induced pluripotent stem cell line ICGi045-A of a RASopathy patient carrying p.Glu329Lys variant in SOS1 Dementyeva E.V., Zaytseva A.K., Minina J.M., Melnik O.V., Zakian S.M., A.A. Kostareva A.A. RUSS J DEV BIOL+, 2024, Vol. 55, No. 1, P. 26–33 |
|
| Studying Pathogenetic Contribution of a Variant of Unknown Significance, p.M659I (c.1977G > A) in MYH7, to the Development of Hypertrophic Cardiomyopathy Using CRISPR/Cas9-Engineered Isogenic Induced Pluripotent Stem Cells Pavlova S.V., Shulgina A.E., Zakian S.M., Dementyeva E.V. INT J MOL SCI, 2024, Vol. 25, 8695 |
|
| Generation of Isogenic iPSC Lines for Studying the Effect of the p.N515del (c.1543_1545delAAC) Variant on MYBPC3 Function and Hypertrophic Cardiomyopathy Pathogenesis Pavlova S.V., Shulgina A.E., Minina J.M., Zakian S.M., Dementyeva E.V. INT J MOL SCI, 2024, Vol. 25, 12900 |
|
| Generation and characterization of two induced pluripotent stem cell lines (ICGi052-A and ICGi052-B) from a patient with frontotemporal dementia with parkinsonism-17 associated with the pathological variant c.2013T>G in the MAPT gene Grigor’eva E.V., Malakhova A.A., Yarkova E.S., Minina J.M., Vyatkin Y.V., Nadtochy J.A., Khabarova E.A., Rzaev J.A., Medvedev S.P., Zakian S.M. Vavilov journal of genetics and breeding, 2024, 28(7):679-687 |
|
| The Generation of Genetically Engineered Human Induced Pluripotent Stem Cells Overexpressing IFN-β for Future Experimental and Clinically Oriented Studies Sheveleva O., Protasova E., Grigor’eva E., Butorina N., Kuziaeva V., Antonov D., Melnikova V., Medvedev S., Lyadova I. INT J MOL SCI, 2024, V. 25. P. 12456. |
|
| Antidiabetic Effect of Dihydrobetulonic Acid Derivatives as Pparα/γ Agonists Khvostov M.V., Blokhin M.E., Borisov S.A., Fomenko V.V., Meshkova Y.V., Zhukova N.A., Nikonova, S.V., Pavlova S.V., Pogosova M.A., Medvedev S.P., Luzina O.A., Salakhutdinov N.F. SCIENTIA PHARMACEUTICA, 2024, V. 92. P. 65. |
|
| 2023 | Фенотипические особенности клеток реберного хряща при воронкообразной деформации грудной клетки. Строкова Е.Л., Пахомова Н.Ю., Шевченко А.И., Корыткин А.А., Кожевников В.В., Зайдман А.М. Cell and Tissue Biology, 2023, Т. 43. № 6. С. 203–209. |
| Mutant-Huntingtin Molecular Pathways Elucidate New Targets for Drug Repurposing Makeeva V.S., Dyrkheeva N.S., Lavrik O.I., Zakian S.M., Malakhova A.A. INT J MOL SCI, 2023, 24(23), 16798 |
|
| Хемокин CCL2 активирует факторы гипоксического ответа, регулирует плюрипотентность и направленную эндотелиальную дифференцировку плюрипотентных стволовых клеток человека // Онтогенез. Шевченко А.И., Арссан М.А., Закиян С.М., Захарова И.С. RUSS J DEV BIOL+, 2023, Т. 54. №2. С. 148-161. |
|
| Calling and Phasing of Single-Nucleotide and Structural Variants of the LDLR Gene Using Oxford Nanopore MinION //Int. J. Mol. Sci. 2023. DOI: Nazarenko M.S., Sleptcov A.A., Zarubin A.A., Salakhov R.R., Shevchenko A.I., Tmoyan N.A., Elisaphenko E.A., Zubkova E.S., Zheltysheva N.V., Ezhov M.V., Kukharchuk V.V., Parfyonova Ye.V., Zakian S.M., Zakharova I.S. INT J MOL SCI, 2023, V. 24: 4471 |
|
| Genetic Redundancy in Rye Shows in a Variety of Ways Alexander V. Vershinin, Evgeny A. Elisafenko and Elena V. Evtushenko Plants, 2023, 12(2), 282 |
|
| Biochemical characteristics of iPSC-derived dopaminergic neurons from N370S GBA variant carriers with and without Parkinson's disease Grigor’eva E.V., Kopytova A.E., Yarkova E.S., Pavlova S.V., Sorogina D.A., Malakhova A.A., Malankhanova T.B., Baydakova G.V., Zakharova E.Y., Medvedev S.P., Pchelina S.N., Zakian S.M. INT J MOL SCI, 2023, 24(5), 4437 |
|
| Создание линии индуцированных плюрипотентных стволовых клеток ICGi043-A с помощью репрограммирования мононуклеарных клеток периферической крови пациента с болезнью Паркинсона, ассоциированной с патологическим вариантом p.G2019S LRRK2 Григорьева Е.В., Павлова С.В., Малахова А.А., Яркова Е.С., Сорогина Д.А., Минина Ю.М., Милюхина И.В., Николаев Н.А., Пчелина С.Н., Медведев С.П., Закиян С.М. Онтогенез, 2023, Т. 54. №1. С. 79–86 |
|
| Создание линии индуцированных плюрипотентных стволовых клеток ICGi042-A с помощью репрограммирования мононуклеарных клеток периферической крови пациента с болезнью Паркинсона, ассоциированной с мутацией c.1000G>A в гене LRRK2 Григорьева Е.В., Павлова С.В., Малахова А.А., Медведев С.П., Минина Ю.М., Вяткин Ю.В., Хабарова Е.А., Рзаев Дж.А., Коваленко Л.В., Закиян С.М. Онтогенез, 2023, Т. 54, №1, C. 87–95 |
|
| Создание линий индуцированных плюрипотентных стволовых клеток ICGi044-B и ICGi044-C с помощью репрограммирования мононуклеарных клеток периферической крови пациента с болезнью Паркинсона, ассоциированной с мутацией c.1492T>G в гене GLUD2 Сорогина Д.А., Григорьева Е.В., Малахова А.А., Павлова С.В., Медведев С.П., Вяткин Ю.В., Хабарова Е.А., Рзаев Дж.А., Закиян С.М. Онтогенез, 2023, Т. 54. № 1. С. 114–122 |
|
| Линия индуцированных плюрипотентных стволовых клеток ICGi023-A, полученная от пациента с полиморфизмами в генах LRRK2 и PINK1, ассоциириванными с болезнью Паркинсона Малахова А.А., Павлова С.В., Григорьева Е.В., Медведев С.П., Минина Ю.М., Вяткин Ю.В., Хабарова Е.А., Рзаев Д.А., Коваленко Л.В., Закиян С.М. Онтогенез, 2023, Т. 54, №1, C. 96–104 |
|
| Transcriptomic Analysis of CRISPR/Cas9-Mediated PARP1-Knockout Cells under the Influence of Topotecan and TDP1 Inhibitor Dyrkheeva N.S., Malakhova A.A., Zakharenko A.L., Okorokova L.S., Shtokalo D.N., Pavlova S.V., Medvedev S.P., Zakian S.M., Nushtaeva A.A., Tupikin A.E., Kabilov M.R., Khodyreva S.N., Luzina O.A., Salakhutdinov N.F., Lavrik O.I. INT J MOL SCI, 2023, V. 24(6). Article number 5148. |
|
| Potential Binding Sites of Pharmacological Chaperone NCGC00241607 on Mutant β-Glucocerebrosidase and Its Efficacy on Patient-Derived Cell Cultures in Gaucher and Parkinson’s Disease // International Journal of Molecular Sciences Kopytova A.E., Rychkov G.N., Cheblokov A.A., Grigor’eva E.V., Nikolaev M.A., Yarkova E.S., Sorogina D.A., Ibatullin F.M., Baydakova G.V., Izyumchenko A.D., Bogdanova D.A., Boitsov V.M., Rybakov A.V., Miliukhina I.V., Bezrukikh V.A., Salogub G.N., Zakharova E.Y., Pchelina S.N., Emelyanov A.K. INT J MOL SCI, 2023, 24, 9105 |
|
| Generation of three induced pluripotent stem cell lines (RAUi001-A, RAUi001-B and RAUi001-C) from peripheral blood mononuclear cells of a healthy Armenian individual Grigor’eva E.V., Malakhova A.A., Ghukasyan L., Hayrapetyan V., Atshemyan S., Vardanyan V., Zakian S.M., Zakharyan R., Arakelyan A. STEM CELL RES, 2023, V. 71, 103147 |
|
| A model of iPSC-derived macrophages with TNFAIP3 overexpression reveals the peculiarities of TNFAIP3 protein expression and function in human macrophages Sheveleva O., Protasova E., Nenasheva T., Butorina N., Melnikova V., Gerasimova T., Sakovnich O., Kurinov A., Grigor’eva E., Medvedev S., Lyadova I. INT J MOL SCI, 2023, 24, 12868. |
|
| Ultrastructural Abnormalities in Induced Pluripotent Stem Cell-Derived Neural Stem Cells and Neurons of Two Cohen Syndrome Patients Shnaider TA, Khabarova AA, Morozova KN, Yunusova AM, Yakovleva SA, Chvileva AS, Wolf ER, Kiseleva EV, Grigor’eva EV, Voinova VY, Lagarkova MA, Pomerantseva EA, Musatova EV, Smirnov AV, Smirnova AV, Stoklitskaya DS, Arefieva TI, Larina DA, Nikitina TV, Pristyazhnyuk IE Cells, 2023 |
|
| Трансгенные линии индуцированных плюрипотентных стволовых клеток человека ICGI022-A-6 и ICGI022-A-7 с доксициклин-управляемыми вариантами программируемой нуклеазы AsCas12a Павлова С.В., Валетдинова К.Р., Маланханова Т.Б., Поливцев Д.Е., Малахова А.А., Григорьева Е.В., Шевченко А.И., Закиян C.М., Медведев С.П. Онтогенез, 2023, Т. 54. № 6. С. 415-428. |
|
| Нокаут по гену PARP1 подавляет экспрессию генов эксцизионной репарации оснований ДНК Захаренко А.Л., Малахова А.А., Дырхеева Н.С., Окорокова Л.С., Медведев С.П., Закиян С.М., Кабилов М.Р., Тупикин А.А., Лаврик О.И. Doklady Akademii Nauk, 2023, Т. 510. С. 219-224. |
|
| PARP1 Gene Knockout Suppresses Expression of DNA Base Excision Repair Genes Zakharenko A.L., Malakhova A.A., Dyrkheeva N.S., Okorokova L.S., Medvedev S.P., Zakian S.M., Kabilov M.R., Tupikin A.A., Lavrik O.I. Doklady Biochemistry and Biophysics, 2023, V. 508. P. 6-11. |
|
| Usnic Acid Derivatives Inhibit DNA Repair Enzymes Tyrosyl-DNA Phosphodiesterases 1 and 2 and Act as Potential Anticancer Agents Zakharenko A.L., Dyrkheeva N.S., Luzina O.A., Filimonov A.S., Mozhaitsev E.S., Malakhova A.A., Medvedev S.P., Zakian S.M., Salakhutdinov N.F., Lavrik O.I. Genes, 2023, V. 14(10). P. 1931. |
|
| Transgenic Lines of Human Induced Pluripotent Stem Cells ICGi022-A-6 and ICGi022-A-7 with Doxycycline-Inducible Variants of Programmable Nuclease AsCas12a Pavlova S.V., Valetdinova K.R., Malankhanova T.B., Polivtsev D.E., Malahova A.A., Grigor’eva E.V., Shevchenko A.I., Zakian S.M., Medvedev S.P. RUSS J DEV BIOL+, 2023, V. 54. P. 374–386. |
|
| ПОЛУЧЕНИЕ ЛИНИЙ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ICGi022-A-3, ICGi022-A-4 И ICGi022-A-5 С ВНЕСЕННОЙ В ГЕН MYBPC3 С ПОМОЩЬЮ СИСТЕМЫ CRISPR/Cas9 МУТАЦИЕЙ p.Asn515del Павлова, С.В., Шаяхметова Л.Ш., Проняева К.А., Шульгина А.Е., Закиян С.М., Дементьева Е. В. Онтогенез, 2023, Т54 1 |
|
| Generation of an Induced Pluripotent Stem Cell Line ICGi046-A
of a Patient Carrying Pathogenic p.Ser259Thr Variant
in RAF1 Associated with RASopathy E. V. Dementyeva, E. S. Klimenko, J. M. Minina, S. M. Zakian, and A. A. Kostareva RUSS J DEV BIOL+, 2023, V. 54, Suppl. 1, S75–S81. |
|
| Получение линий индуцированных плюрипотентных стволовых клеток ICGi022-A-3, ICGi022-A-4 и ICGi022-A-5 с внесенной в ген MYBPC3 с помощью системы CRISPR/Cas9 мутацией p.Asn515del Павлова С.В., Шаяхметова Л.Ш., Проняева К.А., Шульгина А.Е., Закиян С.М., Дементьева Е.В. RUSS J DEV BIOL+, 2023, Т. 54, № 1, С. 105–113 |
|
| Generation of an Induced Pluripotent Stem Cell Line, ICGi042-A, by Reprogramming Peripheral Blood Mononuclear Cells from a Parkinson’s Disease Patient with c.1000G>A Mutation in the LRRK2 Gene Grigor’eva E.V., Pavlova S.V., Malakhova A.A., Medvedev S.P., Minina J.M., Vyatkin Y.V., Khabarova E.A., Rzaev J.A., Kovalenko L.V., Zakian S.M. RUSS J DEV BIOL+, 2023, Vol. 54, No. 1, pp. 80–87 |
|
| Creation of Induced Pluripotent Stem Cells ICGi044-B and ICGi044-C Using Reprogramming of Peripheral Blood Mononuclear Cells of a Patient with Parkinson's Disease Associated with c.1492T>G Mutation in the GLUD2 Gene Sorogina D.A., Grigor’eva E.V., Malakhova A.A., Pavlova S.V., Medvedev S.P., Vyatkin Y.V., Khabarova E.A., Rzaev J.A., Zakian S.M. RUSS J DEV BIOL+, 2023, Vol. 54, No. 1, pp. 104–111 |
|
| An Induced Pluripotent Stem Cell Line (ICGi023-A) Obtained from a Patient with Parkinson’s Disease Associated Polymorphisms in LRRK2 and PINK1 Genes Malakhova A.A., Pavlova S.V., Grigor’eva E.V., Medvedev S.P., Minina J.M., Vyatkin Y.V., Khabarova E.A., Rzaev J.A., Kovalenko L.V., Zakian S.M. RUSS J DEV BIOL+, 2023, Vol. 54, No. 1, pp. 88–95 |
|
| Functional Activity of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes on a Mouse Renal Subcapsular Xenograft Model. Chepeleva EV, Pavlova SV, Bgatova NP, Volkov AM, Kazanskaya GM, Sergeevichev DS. INT J MOL SCI, 2023, Jun 6;24(12):9792. |
|
| 2022 | Constitutive heterochromatin propagation contributes to the X chromosome inactivation Shevchenko A.I., Rifel N.A., Zakian S.M., Zakharova I.S. CHROMOSOME RES, 2022, V. 30, P. 289–307 |
| Generation of induced pluripotent stem cell line, ICGi034-A, by reprogramming peripheral blood mononuclear cells from a patient with Parkinson’s disease associated with GBA mutation Grigor’eva E.V., Drozdova E.S., Sorogina D.A., Malakhova A.A., Pavlova S.V., Vyatkin Y.V., Khabarova E.A., Rzaev J.A., Medvedev S.P., Zakian S.M. STEM CELL RES, 2022, V. 59. 102651 |
|
| CRISPR-Cas9 mediated knockout of AnxA6 gene enhances influenza A virus replication in low-permissive HEK293FT cell line Komissarov A., Sergeeva M., Zhuravlev E., Medvedev S., Malakhova A., Andreeva E., Shurygina A.P., Gorshkov A., Timofeeva M., Balakhonova E., Grudinin M., Zakian S., Richter V., Stepanov G. CRISPR-Cas9 mediated knockout of AnxA6 gene enhances influenza A virus replication in low-permissive HEK293FT cell line GENE, 2022, V. 809. P. 146024. |
|
| Identification of specific gene methylation patterns during motor neuron differentiation from spinal muscular atrophy patient-derived iPSC Maretina M.A., Valetdinova K.R., Tsyganova N.A., Egorova A.A., Ovechkina V.S., Schiöth H.B., Zakian S.M., Baranov V.S., Kiselev A.V. GENE, 2022, V. 811. P. 146109 |
|
| Induced pluripotent stem cell line ICGi036-A generated by reprogramming peripheral blood mononuclear cells from a patient with familial hypercholesterolemia caused due to compound heterozygous p.Ser177Leu/p.Cys352Arg mutations in LDLR Zakharova IS, Shevchenko AI, Tmoyan NA, Elisaphenko EA, Zubkova ES, Sleptcov AA, Nazarenko MS, Ezhov MV, Kukharchuk VV, Parfyonova YV, Zakian SM STEM CELL RES, 2022, 59:102653 |
|
| Oxidative Stress Research on Huntington's Disease Neurons Using Genetically Encoded Biosensors Tuyana Malankhanova, Dayaana Vasileva, Elena Grigor'eva, Sergey Medvedev, Suren Zakian, Anastasia Malakhova KnE life sciences, 2022, KnE Life Sciences, 7(1), 424–434. |
|
| Investigating Antisense Transcription at the HTT Locus Eugeny A. Elisaphenko, Anastasia A. Malakhova KnE life sciences, 2022, KnE Life Sciences, 7(1), 404–411. |
|
| Induced pluripotent stem cell line ICGi037-A, obtained by reprogramming
peripheral blood mononuclear cells from a patient with familial
hypercholesterolemia due to heterozygous p.Trp443Arg mutations in LDLR Irina S. Zakharova, Alexander I. Shevchenko, Narek A. Tmoyan, Eugeny A. Elisaphenko, Alexander P. Kalinin, Aleksei A. Sleptcov, Maria S. Nazarenko, Marat V. Ezhov, Valery V. Kukharchuk, Yelena V. Parfyonova, Suren M. Zakian STEM CELL RES, 2022, 60:102703 |
|
| Induced pluripotent stem cell line ICGi038-A, obtained by reprogramming
peripheral blood mononuclear cells from a patient with familial
hypercholesterolemia due to compound heterozygous c.1246C > T/c.940
+ 3_940 + 6del mutations in LDLR Irina S. Zakharova, Alexander I. Shevchenko, Narek A. Tmoyan, Eugeny A. Elisaphenko, Ekaterina S. Zubkova, Aleksei A. Sleptcov, Maria S. Nazarenko, Marat V. Ezhov, Valery V. Kukharchuk, Yelena V. Parfyonova, Suren M. Zakian STEM CELL RES, 2022, 60:102702 |
|
| Oxidative stress monitoring in iPSC-derived motor neurons using genetically encoded biosensors of H2O2 Ustyantseva E., Pavlova S.V., Malakhova A.A., Ustyantsev K., Zakian S.M., Medvedev S.P. SCI REP-UK, 2022, V. 12(1). Article number 8928. |
|
| Generation of induced pluripotent stem cell line, ICGi033-A, by reprogramming peripheral blood mononuclear cells from a patient with Huntington's disease Grigor’eva E.V., Malakhova A.A., Sorogina D.A., Pavlova S.V., Malankhanova T.B., Abramycheva N.Yu., Klyushnikov S.A., Illarioshkin S.N., Zakian S.M. STEM CELL RES, 2022, 63. 102868. |
|
| Таргетная терапия болезни Паркинсона Копытова А.Э., Усенко Т.С., Емельянов А.К., Байдакова Г.В., Григорьева Е.В., Рычков Г.Н., Ибатуллин Ф.М., Захарова Е.Ю., Закиян С.М., Пчелина С.Н. Бюллетень Национального общества по изучению болезни Паркинсона и расстройств движений, 2022, №2. С. 103-110. |
|
| The Precise Breakpoint Mapping in Paracentric Inversion 10q22.2q23.3 by Comprehensive Cytogenomic Analysis, Multicolor Banding, and Single-Copy Chromosome Sequencing Tatyana V. Karamysheva, Tatyana A. Gayner, Eugeny A. Elisaphenko, Vladimir A. Trifonov, Elvira G. Zakirova, Konstantin E. Orishchenko, Mariya A. Prokhorovich, Maria E. Lopatkina, Nikolay A. Skryabin, Igor N. Lebedev, Nikolay B. Rubtsov Biomedicines, 2022, 10, 3255 |
|
| Adamantane-Monoterpenoid Conjugates Linked via Heterocyclic Linkers Enhance the Cytotoxic Effect of Topotecan Munkuev AA, Dyrkheeva NS, Kornienko TE, Ilina ES, Ivankin DI, Suslov EV, Korchagina DV, Gatilov YV, Zakharenko AL, Malakhova AA, Reynisson J, Volcho KP, Salakhutdinov NF, Lavrik OI. MOLECULES, 2022, 27(11):3374 |
|
| Nanoscale Detonation Carbon Demonstrates Biosafety in Human Cell Culture Malakhova AA, Rybin DK, Shtertser AA, Dudina DV. Micromachines, 2022, 13(8):1187 |
|
| Mitomycin-Treated Endothelial and Smooth Muscle Cells Suitable for Safe Tissue Engineering Approaches Zakharova I, Saaya S, Shevchenko A, Stupnikova A, Zhiven' M, Laktionov P, Stepanova A, Romashchenko A, Yanshole L, Chernonosov A, Volkov A, Kizilova E, Zavjalov E, Chernyavsky A, Romanov A, Karpenko A, Zakian S Front Bioengineer Biotechnol, 2022 |
|
| 2021 | Etiopathogenesis of adolescent idiopathic scoliosis: Review of the literature and new epigenetic hypothesis on altered neural crest cells migration in early embryogenesis as the key event Zaydman A.M., Strokova E.L., Pahomova N.Y., Gusev A.F., Mikhaylovskiy M.V., Shevchenko A.I., Zaidman M.N., Shilo A.R., Subbotin V.M. MED HYPOTHESES, 2021, V. 151. № 7:110585 |
| Prenatal Diagnosis of Small Supernumerary Marker Chromosome 10 by Array-Based Comparative Genomic Hybridization and Microdissected Chromosome Sequencing. BIOMEDICINES. 2021. Lebedev I.N. Karamysheva T.V., Elisaphenko E.A., Makunin, A.I., Zhigalina D.I., Lopatkina M.E., Drozdov G.V., Cheremnykh A.D., Torkhova N.B., Seitova G.N., Vasilyev S. A., Kashevarova A.A., Nazarenko, L.P., Rubtsov, N.B. Biomedicines, 2021, V.9, no 8, #1030. |
|
| Expression of Two Rye CENH3 Variants and Their Loading into
Centromeres Elena V. Evtushenko, Evgeny A. Elisafenko, Sima S. Gatzkaya, Veit Schubert, Andreas Houben, Alexander V. Vershinin Plants, 2021, V.10(10), 2043 |
|
| Generation of an induced pluripotent stem cell line ICGi030-A from a Wilson’s disease patient carrying a frameshift mutation p.Lys1013fs and missense mutation p.H1069Q in the ATP7B gene Zhigalina D.I., Malakhova A.A., Vasilyeva O.Yu., Grigor’eva E.V., Sivtsev A.A., Kolesnikov N.A., Lopatkina M.E., Savchenko R.R., Zhalsanova I.Zh., Postrigan’ A.E., Zarubin A.A., Nikitina T.V., Bueverov A.O., Bogomolov P.O., Zakian S.M., Skryabin N.A. STEM CELL RES, 2021, V. 57. 102556. |
|
| The Cutting Edge of Disease Modeling: Synergy of Induced Pluripotent Stem Cell Technology and Genetically Encoded Biosensors Valetdinova K.R., Malankhanova T.B., Zakian S.M., Medvedev S.P. Biomedicines, 2021, V. 9(8). P. 960. |
|
| New Hybrid Compounds Combining Fragments of Usnic Acid and Monoterpenoids for Effective Tyrosyl-DNA Phosphodiesterase 1 Inhibition Dyrkheeva N.S., Filimonov A.S., Luzina O.A., Zakharenko A.L., Ilina E.S., Malakhova A.A., Medvedev S.P., Reynisson J., Volcho K.P., Zakian S.M., Salakhutdinov N.F., Lavrik O.I. Biomolecules, 2021, V. 11(7). P. 973 |
|
| Mild phenotype of knockouts of the major apurinic/apyrimidinic endonuclease APEX1 in a non-cancer human cell line Kim D.V., Kulishova L.M., Torgasheva N.A., Melentyev V.S., Dianov G.L., Medvedev S.P., Zakian S.M., Zharkov D.O. PloS One, 2021, V.16(9). P. e0257473 |
|
| Создание и исследование клеточных моделей наследственных нейродегенеративных заболеваний с помощью направленного редактирования геномов Медведев С.П., Маланханова Т.Б., Валетдинова К.Р., Закиян С.М. Нейрохимия, 2021, Т. 38. № 4. С. 313-319 |
|
| New Hybrid Compounds Combining Fragments of Usnic Acid and Thioether Are Inhibitors of Human Enzymes TDP1, TDP2 and PARP1 Dyrkheeva N.S., Filimonov A.S., Luzina O.A., Orlova K.A., Chernyshova I.A., Kornienko T.E., Malakhova A.A., Medvedev S.P., Zakharenko A.L., Ilina E.S., Anarbaev R.O., Naumenko K.N., Klabenkova K.V., Burakova E.A., Stetsenko D.A., Zakian S.M., Salakhutdinov N.F., Lavrik O.I. INT J MOL SCI, 2021, V. 22(21). P.11336. |
|
| Genetically Encoded Fluorescent Biosensors for Biomedical Applications Ovechkina V.S., Zakian S.M., Medvedev S.P., Valetdinova K.R. Biomedicines, 2021, V. 9(11). P. 1528 |
|
| Generation of Transgenic Rat Embryonic Stem Cells Using the CRISPR/Cpf1 System for Inducible Gene Knockout Sherstyuk V.V., Zakian S.M. BIOCHEMISTRY-MOSCOW+, 2021, V. 86(7). P. 843-851 |
|
| Electron microscopic analysis of autophagy in neurons
with expanded CAG repeats in the huntingtin gene in patientspecific and transgenic cell model Lyubov Suldina, Ksenia Morozova, Tuyana Malanhanova, Anastasia Malakhova, Elena Kiseleva Cell Death Discovery, 2021, (2021) 7:1–14 |
|
| Эффективность программируемых нуклеаз SpCas9 и AsCpf1 (Cas12a) в геномных локусах safe harbor клеток линии HEK293 Павлова С.В., Елисафенко Е.А., Шаяхметова Л.Ш., Медведев С.П. Альманах клинической медицины, 2021, T. 49. № 6. С. 385-395 |
|
| The origin and evolution of a two-
component system of paralogous genes
encoding the centromeric histone CENH3
in cereals Evgeny A. Elisafenko , Elena V. Evtushenko and Alexander V. Vershinin BMC PLANT BIOL, 2021, V.21, Article number: 541 (2021) |
|
| Creation and Research of Cell Models of Hereditary Neurodegenerative Diseases Using Directed Genome Editing Medvedev S.P., Malankhanova T.B., Valetdinova K.R., Zakian S.M. NEUROCHEM J+, 2021, V. 15. No. 4, P. 353-358. |
|
| Generation of an induced pluripotent stem cell line, ICGi029-A, by reprogramming peripheral blood mononuclear cells of a patient suffering from hypertrophic cardiomyopathy and carrying a heterozygous p.N515del mutation in MYBPC3 Dementyeva E.V., Pavlova S.V., Chernyavsky A.M., Zakian S.M. STEM CELL RES, 2021, V. 53, 102344 |
|
| Generation of an induced pluripotent stem cell line, ICGi028-A, by reprogramming peripheral blood mononuclear cells of a patient suffering from hypertrophic cardiomyopathy and carrying a heterozygous p.E510Q mutation in HADHA Dementyeva E.V., Vyatkin Yu.V., Chernyavsky A.M., Zakian S.M. STEM CELL RES, 2021, V. 53, 102348 |
|
| 2020 | Сryptic species of Anopheles messeae sensu lato (Diptera: Culicidae), their identification, features, and nomenclature Novikov Yu.M., Shevchenko A.I. Вестник Томского государственного университета. Биология., 2020, №51. С.69-85 |
| Design, synthesis, and biological investigation of novel classes of 3-carene-derived potent inhibitors of TDP1 Il'ina I.V., Dyrkheeva N.S., Zakharenko A.L., Sidorenko A.Y., Li-Zhulanov N.S., Korchagina D.V., Chand R., Ayine-Tora D.M., Chepanova A.A., Zakharova O.D., Ilina E.S., Reynisson J., Malakhova A.A., Medvedev S.P., Zakian S.M., Volcho K.P., Salakhutdinov N.F., Lavrik O.I. MOLECULES, 2020, V. 25(15). 3496. |
|
| CellCountCV-A Web-application for accurate cell counting and automated batch processing of microscopic images using fully convolutional neural networks Antonets D., Russkikh N., Sanchez A., Kovalenko V., Bairamova E., Shtokalo D., Medvedev S., Zakian S. SENSORS-BASEL, 2020, V. 20(13). E3653. |
|
| Получение и характеристика эмбриональных стволовых клеток человека с повышенной экспрессией HIF-2A Живень М.К., Захарова И.С., Шевченко А.И., Елисафенко Е., Орищенко К.Е., Закиян С.М. Гены и клетки, 2020, Т. 15. № 1. С. 29-36. |
|
| Generation of induced pluripotent stem cell line ICGi018-A from peripheral blood mononuclear cells of a patient with Huntington’s disease Malakhova A.A., Grigor’eva E.V., Malankhanova T.B., Pavlova S.V., Valetdinova K.R., Abramycheva N.Yu., Vetchinova A.S., Illarioshkin S.N., Zakian S.M. STEM CELL RES, 2020, V. 44, 101743 |
|
| Generation of GABAergic striatal neurons by a novel iPSC differentiation protocol enabling scalability and cryopreservation of progenitor cells Grigor’eva E.V., Malankhanova T.B., Surumbayeva A., Pavlova S.V., Minina J.M., Kizilova E.A., Suldina L.A., Morozova K.N., Kiseleva E., Sorokoumov E.D., Lebedev I.N., Zakian S.M, Malakhova A.A. CYTOTECHNOLOGY, 2020 |
|
| Macrophages derived from human induced pluripotent stem cells are low-activated ‘naïve-like’ cells capable of restricting mycobacteria growth Nenasheva T.A., Gerasimova T.P., Serdyuk Y.V., Grigor'eva E.V., Kosmisdi G.A., Nikolaev A., Dashinimaev E., Lyadova I.V. Frontiers in Immunology, 2020, V. 11. Article 1016 |
|
| Generation of induced pluripotent stem cell lines ICGi021-A and ICGi022-A from peripheral blood mononuclear cells of two healthy individuals from Siberian population Malakhova A.A., Grigor'eva E.V., Pavlova S.V., Malankhanova T.B., Valetdinova K.R., Vyatkin Y.V., Khabarova E.A., Rzaev J.A., Zakian S.M., Medvedev S.P. STEM CELL RES, 2020, 48. 101952. |
|
| Generation of two induced pluripotent stem cell lines from peripheral blood mononuclear cells of a patient with Wilson's disease Malakhova A.A., Grigor'eva E.V., Vasilyeva O.Yu., Zhigalina D.I., Skryabin N.A., Sivtcev A.A., Kolesnikov N.A., Bueverov A.O., Lebedev I.N., Bogomolov P.O., Zakian S.M. STEM CELL RES, 2020, 47. 101922. |
|
| Comparative Metabolomic Profiling of Rat Embryonic and Induced Pluripotent Stem Cells Sherstyuk V.V., Yanshole L.V., Zelentsova E.A., Melnikov A.D., Medvedev S.P., Tsentalovich Y.P., Zakian S.M. STEM CELL REV REP, 2020, V. 16, № 6, P. 1256-1265 |
|
| A Human Induced Pluripotent Stem Cell-Derived
Isogenic Model of Huntington’s Disease Based on
Neuronal Cells Has Several Relevant
Phenotypic Abnormalities Tuyana Malankhanova, Lyubov Suldina, Elena Grigor'eva, Sergey Medvedev, Julia Minina, Ksenia Morozova, Elena Kiseleva, Suren Zakian, Anastasia Malakhova J. Pers. Med, 2020 |
|
| Generation of three Duchenne muscular dystrophy patient-derived induced pluripotent stem cell (iPSC) lines ICGi002-A, ICGi002-B and ICGi002-C. Valetdinova KR, Maretina MA, Vyatkin YV, Perepelkina MP, Egorova AA, Baranov VS, Kiselev AV, Gershovich PM, Zakian SM. STEM CELL RES, 2020, 48:101941 |
|
| Generation of a spinal muscular atrophy type III patient-specific induced pluripotent stem cell line ICGi003-A Ovechkina VS, Maretina MA, Egorova AA, Baranov VS, Kiselev AV, Zakian SM, Valetdinova KR. STEM CELL RES, 2020, 48:101938 |
|
| Introducing an Expanded Trinucleotide
Repeat Tract into the Human Genome for
Huntington’s Disease Modeling In Vitro Tuyana Malankhanova, Michael Sorokin, Sergey Medvedev, Suren Zakian, Anastasia Malakhova Current protocols in human genetics., 2020 |
|
| Generation of two clonal iPSC lines, ICGi019-A and ICGi019-B, by reprogramming peripheral blood mononuclear cells of a patient suffering from hypertrophic cardiomyopathy and carrying a heterozygous p.M659I mutation in MYH7 Dementyeva E.V., Kovalenko V.R., Zhiven M.K., Ustyantseva E.I., Kretov E.I., Vyatkin Yu.V., Zakian S.M. STEM CELL RES, 2020, Vol. 46, P. 101840 |
|
| Генетический анализ пациентов с гипертрофической кардиомиопатией Дементьева Е.В., Вяткин Ю.В., Кретов Е.И., Елисафенко Е.А., Медведев С.П., Закиян С.М. Гены и клетки, 2020, Том XV, № 3, С. 68-73 |
|
| Studying ALS: current approaches, effect on potential treatment strategy Ustyantseva E.I., Medvedev S.P., Zakian S.M. ADV EXP MED BIOL, 2020, V. 1241. P. 195-217. |
|
| 2019 | Этапы гистогенеза остеогенного трансплантата в культуральной среде и реципиентном ложе Зайдман А.М., Шевченко А.И., Строкова Е.Л., Гусев А.Ф., Пахомова Н.Ю., Кирилова И.А., Рерих В.В., Субботин В.М. Цитология, 2019, Т. 61. № 5; С. 370-384. |
| Diverse developmental strategies of X chromosome dosage compensation in eutherian mammals Shevchenko A.I., Demetyeva E.V., Zakharova I.S., Zakyan S.M. INT J DEV BIOL, 2019, V.63. P. 223-233. |
|
| A New Look at Causal Factors of Idiopathic Scoliosis: Altered Expression of Genes Controlling Chondroitin Sulfate Sulfation and Corresponding Changes in Protein Synthesis in Vertebral Body Growth Plates Zaydman A.M., Strokova E.L., Stepanova A.O., Laktionov P.P., Shevchenko A.I., Subbotin V.M. INT J MED SCI, 2019, V.16. № 2. P. 221-230 |
|
| Generation of induced pluripotent stem cell line, ICGi007-A, by reprogramming peripheral blood mononuclear cells from a patient with Huntington’s disease Grigor’eva E.V., Malankhanova T.B., Surumbayeva A., Minina J.M., Morozov V.V., Abramycheva N.Yu., Illarioshkin S.N., Malakhova A.A., Zakian S.M. STEM CELL RES, 2019, V. 34, 101382. |
|
| Generation of two spinal muscular atrophy (SMA) type I patient-derived induced pluripotent stem cell (iPSC) lines and two SMA type II patientderived iPSC lines Valetdinova K.R., Maretina M.A., Kuranova M.L., Grigor’eva E.V., Minina Y.M., Kizilova E.A., Kiselev A.V., Medvedev S.P., Baranov V.S., Zakian S.M. STEM CELL RES, 2019, V. 34, 101376. |
|
| Generation of two iPSC lines (ICGi008-A and ICGi008-B) from skin fibroblasts of a patient with early-onset Alzheimer’s disease caused by London familial APP mutation (V717I) Grigor’eva E.V., Malankhanova T.B., Ustyantseva E.I., Minina J.M., Redina O.E., Morozov V.V., Shevela A.I., Zakian S.M, Medvedev S.P. STEM CELL RES, 2019, V. 36. 101415. |
|
| Методы коррекции однонуклеотидной замены с.840С>Т в 7-ом экзоне гена SMN2 Валетдинова К.Р., Овечкина В.С., Закиян С.М. Биохимия, 2019, Т. 84, №9, стр. 1322-1334. |
|
| The Use of iPSC-Derived Cardiomyocytes and Optical Mapping for Erythromycin Arrhythmogenicity Testing Podgurskaya A.D., Tsvelaya V.A., Slotvitsky M.M., Dementyeva E.V., Valetdinova K.R., Agladze K.I. CARDIOVASC TOXICOL, 2019, Vol. 19, N 6, P. 518-528 |
|
| Generation of two iPSC lines, (ICGi015-A and ICGi015-B), by reprogramming peripheral blood mononuclear cells from a patient with Parkinson's disease Sharipova D.V., Kovalenko V.R., Bairamova E.M., Vartanova V.A., Grigor'eva E.V., Vyatkin Y.V., Khabarova E.A., Rzaev D.A., Zakian S.M., Medvedev S.P. STEM CELL RES, 2019, SCR 101652 |
|
| Platform for studying neurodegeneration mechanisms using genetically encoded biosensors Ustyantseva E.I., Medvedev S.P., Vetchinova A.S., Minina J.M., Illarioshkin S. N., Zakian S.M. BIOCHEMISTRY-MOSCOW+, 2019, V. 84. N. 3. P. 299-309 |
|
| Dysfunction telomeres in embryonic fibroblasts and cultured in vitro pluripotent stem cells of Rattus norvegicus (Rodentia, Muridae) Zhdanova NS, Vaskova EA, Karamysheva TV, Minina JM, Rubtsov NB, Zakian SM COMP CYTOGENET, 2019, 13(3):1-14 |
|
| Новый кластер микроРНК, ответственный за репрограммирование к плюрипотентному состоянию Шерстюк В.В., Давлетшина Г.И., Вяткин Ю.В., Штокало Д.Н., Власов В.В., Закиян С.М. Acta Naturae, 2019, Т. 11, № 2, С. 92-97 |
|
| A New MicroRNA Cluster Involved in the Reprogramming to a Pluripotent State Sherstyuk V.V., Davletshina G.I., Vyatkin Y.V., Shtokalo D.N., Vlasov V.V., Zakian S.M. Acta Naturae, 2019, V. 11, № 2, P. 92-97 |
|
| Исследование мутантного фенотипа изогенной клеточной модели болезни Хантингтона Маланханова Т.Б., Григорьева Е.В., Сульдина Л.А., Морозова К.Н., Киселева Е.В., Закиян С.М., Малахова А.А. Гены и клетки, 2019, Том XIV. Приложение. С. 144. |
|
| Generation of an induced pluripotent stem cell line, ICGi014-A, by reprogramming peripheral blood mononuclear cells from a patient with homozygous D90A mutation in SOD1 causing Amyotrophic lateral sclerosis Ustyantseva E. I., Medvedev S. P., Vetchinova A. S., Illarioshkin S. N., Leonov S. V., Zakian S.M. STEM CELL RES, 2019, Vol. 42, 101675 |
|
| Increase in Sensitivity of HEK293FT Cell to Influenza Infection by CRISPR-Cas9-Mediated Knockout of IRF7 Transcription Factor A. B. Komissarov, M. V. Sergeeva, E. V. Mozhaeva, N. V. Eshchenko, A. D. Vasilyeva, K. A. Vasiliev, S. P. Medvedev, A. A. Malakhova, E. A. Balakhonova, S. Yu. Malanin,T. V. Grigorieva, E. S. Zhuravlev, D. V. Semenov, V. A. Richter, G. A. Stepanov RUSS J BIOORG CHEM+, 2019, Vol. 45, No. 6, pp. 749–757. |
|
| Arrhythmogenicity test based on a human induced pluripotent stem cell (iPSC)-derived cardiomyocyte layer Slotvitsky M., Tsvelaya V., Frolova S., Dementyeva E., Agladze K. TOXICOL SCI, 2019, V. 168. № 1. P. 70-77 |
|
| Applying patient-specific induced pluripotent stem cells to create a model of hypertrophic cardiomyopathy Dementyeva E.V., Medvedev S.P., Kovalenko V.R., Vyatkin Yu.V., Kretov E.I., Slotvitsky M.M., Shtokalo D.N., Pokushalov E.A., Zakian S.M. BIOCHEMISTRY-MOSCOW+, 2019, V. 84. № 3. P. 291-298 |
|
| Разработка клеточных технологий для регенерации сосудов Захарова И.С., Живень М.К, Ступникова А.С., Шевченко А.И., Закиян С.М. Гены и клетки, 2019, Т. 14. Номер S1. С. 95-96. |
|
| Methods for Correction of the Single-Nucleotide Substitution c.840C > T in Exon 7 of the SMN2 Gene Valetdinova, K. R., Ovechkina, V. S., Zakian S. M. BIOCHEMISTRY-MOSCOW+, 2019, V. 84(9). P. 1074-1084. |
|
| 2018 | A New Look at Etiological Factors of Idiopathic
Scoliosis: Neural Crest Cells Zaydman A.M., Strokova E.L., Kiseleva E.V., Suldina L.A., Strunov A.A.,Shevchenko A.I., Laktionov P.P., Subbotin V.M. INT J MED SCI, 2018, 15(5): 436-446 |
| Impact of Xist RNA on chromatin modifications and transcriptional silencing maintenance at different stages of imprinted X chromosome inactivation in vole Microtus levis Shevchenko A.I., Grigor'eva E.V., Medvedev S.P., Zakharova I.S., Dementyeva E.V., Elisaphenko E.A., Malakhova A.A., Pavlova S.V., Zakian S.M. CHROMOSOMA, 2018, V. 127; № 1; P. 129-139. |
|
| Noncoding RNAs in the Regulation of Pluripotency and Reprogramming Sherstyuk VV, Medvedev SP, Zakian SM STEM CELL REV REP, 2018, V. 14. - № 1. - P. 58-70 |
|
| Поиск микроРНК, потенциально задействованных в поддержании самообновления плюрипотентных клеток лабораторной крысы Шерстюк В.В., Медведев С.П., Ри М.Т., Вяткин Ю.В., Сайк О.В., Штокало Д.Н., Закиян С.М. Vavilov journal of genetics and breeding, 2018, Т. 22, № 2, С. 179-186 |
|
| Ultrastructural defects in isogenic lines of human cells with expanded CAG repeats in the huntingtin gene obtained via the CRISPR/Cas9 technology K.N. Morozova, L.A. Suldina, T.B. Malankhanova, E.V. Grigor'eva, S.M. Zakian, E. Kiseleva, A.A. Malakhova Гены и клетки, 2018, 2, 77 |
|
| Introducing an expanded CAG tract into the huntingtin gene causes a wide spectrum of ultrastructural defects in cultured human cells. Morozova KN, Suldina LA, Malankhanova TB, Grigor'eva EV, Zakian SM, Kiseleva E, Malakhova AA. PloS One, 2018, 13(10) |
|
| Исследование функциональности получаемых из индуцированных плюрипотентных стволовых клеток кардиомиоцитов для моделирования сердечных аритмий при синдроме удлиненного интервала QT Слотвицкий М.М., Цвелая В.А., Фролова Ш.Р., Дементьева Е.В., Агладзе К.И. Vavilov journal of genetics and breeding, 2018, Т. 22. С. 187-195. |
|
| Исследование выживаемости и функциональной активности кардиомиоцитов, дифференцированных из ИПСК человека, при трансплантации в мышей линии SCID Павлова С.В., Чепелева Е.В., Дементьева Е.В., Григорьева Е.В., Сорокоумов Е.Д., Слотвицкий М.М., Понаморенко А.В., Малахова А.А., Докучаева А.А., Сергеевичев Д.С., Покушалов Е.А., Закиян С.М. Гены и клетки, 2018, Том XIII, №4. С. 51-60. |
|
| Синдром удлиненного интервала QT: генетический анализ пациентов Дементьева Е.В., Медведев С.П., Елисафенко Е.А., Байрамова С.А., Покушалов Е.А., Агладзе К.И., Закиян С.М. Гены и клетки, 2018, Т. XIII. № 4. С. 75-80 |
|
| 2017 | Что на роду написано, того не миновать? Редактирование генома в терапии наследственных заболеваний Немудрый А.А., Закиян С.М. Наука из первых рук, 2017, том 75, №4 |
| Био- и гемосвместимость тканеинженерных конструкций из поликапролактона, заселенных человеческими эндотелиальными и гладкомышечными клетками, после имплантации в брюшную аорту мышам SCID Саая Ш.Б., Захарова И.С., Живень М.К., Шевченко А.И., Смирнова А.М., Лактионов П.П., Степанова А.О., Ромащенко А.В., Волков А.М., Завьялов Е.Л., Покушалов Е.А., Иванова Л.Н., Закиян С.М., Карпенко А.А. КОМПЛЕКСНЫЕ ПРОБЛЕМЫ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, 2017, № 3. С. 47-63. |
|
| Endothelial and smooth muscle cells derived from human cardiac explants demonstrate angiogenic potential and suitable for design of cell-containing vascular grafts I. S. Zakharova, M. K. Zhiven’, Sh. B. Saaya, A. I. Shevchenko, A. M. Smirnova,A. Strunov, A. A. Karpenko,3 E. A. Pokushalov, L. N. Ivanova, P. I. Makarevich, Y. V. Parfyonova, E. Aboian, and S. M. Zakian J TRANSL MED, 2017, V. 15. № 54. |
|
| Genome-wide profiling and differential expression of microRNA in rat pluripotent stem cells Sherstyuk V.V., Medvedev S.P., Elisaphenko E.A., Vaskova E.A., Ri M.T., Vyatkin Y.V., Saik O.V., Shtokalo D.N., Pokushalov E.A., Zakian S.M. SCI REP-UK, 2017, V. 7. - № 1. - P. 2787 |
|
| Исследование мутагенного действия нового противотуберкулезного средства «Декстразид» А. В. Троицкий, Е. П. Гуляева, В. С. Медведев, А. А. Старостенко, Т. Н. Быстрова, В. А. Шкурупий, Н. Б. Рубцов, Т. В. Карамышева, М. Н. Бочкарев, Л. А. Герлинская, Д. В. Петровский Экспериментальная и клиническая фармакология, 2017, Т. 80. – №. 8. – С. 31-34. |
|
| Клеточные модели, геномные технологии и клиническая практика: синтез знаний для исследования механизмов, диагностики и терапии болезни Паркинсона В.Р. Коваленко, Е.А. Хабарова, Д.А. Рзаев, С.П. Медведев Гены и клетки, 2017, Том XII, № 2, С. 11-28. |
|
| Modern Genome Editing Technologies in Huntington's Disease Research Malankhanova T.B., Malakhova A.A., Medvedev S.P., Zakian S.M. J Huntingtons Dis., 2017, V.6(1). P. 19-31. |
|
| Моделирование болезни Хантингтона на клетках линии HEK293 Шарипова Д.В., Маланханова Т.Б., Малахова А.А. Vavilov journal of genetics and breeding, 2017, 21(7):856-861 |
|
| Паттерн экспрессии и альтернативный сплайсинг гена HTT в тканях человека Малахова А.А., Елисафенко Е.А. Гены и клетки, 2017, №4, С. 26-32. |
|
| Ecological preferences of Metarhizium spp. from Russia and neighboring territories and their activity against Colorado potato beetle larvae Vadim Kryukov, Olga Yaroslavtseva , Maksim Tyurin, Yuriy Akhanaev, Evgeniy Elisaphenko, Ting-Chi Wen, Oksana Tomilova, Yuri Tokarev, Viktor Glupov J INVERTEBR PATHOL, 2017, Oct;149:1-7 |
|
| ФЕНОТИПИЧЕСКИЕ И ГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ ЭНТОМОПАРАЗИТИЧЕСКОГО АСКОМИЦЕТА BEAUVERIA BASSIANA ПРИ ПАССИРОВАНИИ ЧЕРЕЗ РАЗНЫХ ХОЗЯЕВ В. Ю. Крюков, У. Н. Роцкая, О. Н. Ярославцева, Е. А. Елисафенко, Б. А. Дуйсембеков, В. В. Глупов Паразитология, 2017, Т.51,№ 1,с.3-14 |
|
| Перспективы создания пейсмейкерной сердечной ткани с использованием современных генетических и тканеинженерных технологий Байрамова С.А., Стрельников А.Г., Романов А.Б., Якубов А.А., Лосик Д.В., Павлова С.В., Агладзе К.Г., Покушалов Е.А. Гены и клетки, 2017, Гены и Клетки: Том XII, №2, 2017 год, стр.: 29-36 |
|
| Chromosomal assignment of centromere-specific histone CENH3 genes in rye (Secale cereale L.) and their phylogeny Yulia A. Lipikhina, Elena V. Evtushenko, Evgeny A. Elisafenko, Alexander V. Vershinin COMP CYTOGENET, 2017, v11, i4, p. 821–832 (2017) |
|
| Conserved molecular structure of the centromeric histone CENH3 in Secale and its phylogenetic relationships E. V. Evtushenko, E. A. Elisafenko, S. S. Gatzkaya, Y. A. Lipikhina, A. Houben & A. V. Vershinin SCI REP-UK, 2017, N 7, Article number: 17628 (2017) |
|
| Alternative dominance of the parental genomes in hybrid cells generated through the fusion of mouse embryonic stem cells with fibroblasts Matveeva N.M., Fishman V.S., Zakharova I.S., Shevchenko A.I., Pristyazhnyuk I.E., Menzorov A.G., Serov O.L. SCI REP-UK, 2017, 7(1):18094. |
|
| Мониторинг трансплантации клеток кардиосфер в фибриновом геле в зону ишемического повреждения миокарда с использованием люциферазной репортерной системы С.В. Павлова, Е.А. Леонова, Е.В. Чепелева, А.А. Докучаева, Д.С. Сергеевичев, Е.А. Покушалов Гены и клетки, 2017, Том XII, №4, стр.69-75 |
|
| ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОЙ СОВМЕСТИМОСТИ ПОЛИЛАКТИДНЫХ НАНОВОЛОКОННЫХ МАТРИКСОВ, ЗАСЕЛЕННЫХ ФИБРОБЛАСТАМИ СЕРДЦА, В ЭКСПЕРИМЕНТЕ НА МИНИ-СВИНЬЯХ Е.В. Чепелева, В.А. Балашов, А.А. Докучаева, А.А. Коробейников, А.Г. Стрельников, С.О. Лепендин, С.В. Павлова, К.И. Агладзе, Д.С. Сергеевичев, Е.А. Покушалов Гены и клетки, 2017, Том XII, №4, стр.62-68 |
|
| Использование системы CRISPR/Cas9 для изучения клеточной модели спинальной мышечной атрофии Валетдинова К.Р., Овечкина В.С., Григорьева Е.В., Маретина М.А., Киселев А.В., Баранов В.С., Медведев С.П., Закиян С.М. Гены и клетки, 2017, Т. XII. № 3. 2017. С.54-55. |
|
| Создание протокола направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека в средние шипиковые нейроны с возможностью продолжительного культивирования и трансгенеза предшественников данных клеток Григорьева Е.В., Маланханова Т.Б., Сурумбаева А., Павлова С.В., Малахова А.А., Закиян С.М. Гены и клетки, 2017, Том XII, No 3, 2017, стр. 76. |
|
| Оптимизация инструментов геномного редактирования для получения клеточных моделей болезни Хантингтона Маланханова Т.Б., Малахова А.А., Закиян С.М. Гены и клетки, 2017, Том 12, №3. С. 155. |
|
| Особенности регенерации костной ткани тел позвонков на основе остеотрансплантата в эксперименте Зайдман А.М., Предеин Ю.А., Корель А.В., Щелкунова Е.И., Строкова Е.И., Ластевский А.Д., Рерих В.В., Шевченко А.И. КОМПЛЕКСНЫЕ ПРОБЛЕМЫ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, 2017, T. 6. № 4. С. 95-102 |
|
| ПОЛУЧЕНИЕ ГЕНЕТИЧЕСКИ-МОДИФИЦИРОВАННОЙ ЛИНИИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА, ЭКСПРЕССИРУЮЩЕЙ HIF-ФАКТОР, ИНДУЦИРУЕМЫЙ ГИПОКСИЕЙ ЗАХАРОВА И.С., СМИРНОВА А.М., ЖИВЕНЬ М.К., ШЕВЧЕНКО А.И., ГРИГОРЬЕВА Е.В., ЕЛИСАФЕНКО Е.А., ЗАКИЯН С.М. Гены и клетки, 2017, Том 12, номер 3, Год 2017, страницы 97-98 |
|
| 2016 | Dynamic properties of SOD1 mutants can predict survival time of patients carrying familial amyotrophic lateral sclerosis Nikolay A. Alemasova, Nikita V. Ivanisenko, Sergey P. Medvedev, Suren M. Zakian, Nikolay A. Kolchanov & Vladimir A. Ivanisenko Journal Of Biomolecular Structure & Dynamics, 2016, 2017, Volume 35, Issue 3, Pages 645-656 |
| The expansion of heterochromatin blocks in rye reflects the co-amplification of tandem repeats and adjacent transposable elements. Evtushenko EV, Levitsky VG, Elisafenko EA, Gunbin KV, Belousov AI, Šafář J, Doležel J, Vershinin AV. BMC GENOMICS, 2016, 17(1):337 |
|
| Применение системы CRISPR/Cas9 для создания и исследования клеточных моделей наследственных заболеваний человека Валетдинова К.Р. Гены и клетки, 2016, Т. XI. № 2. С. 10-20. |
|
| Дифференцировка в нейральном направлении пациент-специфичных индуцированных плюрипотентных стволовых клеток от больных с наследственной формой спинальной мышечной атрофии Григорьева Е.В., Валетдинова К.Р., Устьянцева Е.И., Шевченко А.И., Медведев С.П., Мазурок Н.И., Маретина М.А., Куранова М.Л., Киселев А.В., Баранов В.С., Закиян С.М. Гены и клетки, 2016, Т. XI. № 2. С. 70-81. |
|
| Использование методов редактирования генома для создания изогенных клеточных линий, моделирующих болезнь Хантингтона in vitro Малахова А.А., Сорокин М.А., Сорокина А.Е., Маланханова Т.Б., Мазурок Н.А., Медведев С.П., Закиян С.М. Гены и клетки, 2016, Том XI, №2, С. 106-113 |
|
| Стратегии редактирования паралогичных генов с помощью CRISPR/Cas9 Немудрый А.А., Маланханова Т.Б., Малахова А.А., Медведев С.П., Закиян С.М. Гены и клетки, 2016, Том XI, №2, С. 87-94 |
|
| Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes Afford New Opportunities in Inherited Cardiovascular Disease Modeling Bayzigitov D.R, Medvedev S.P, Dementyeva E.V, Bayramova S.A, Pokushalov E.A, Karaskov AM, Zakian S.M. Cardiol Res Pract, 2016, 2016:3582380. doi: 10.1155/2016/3582380. |
|
| The Molecular Mechanisms of Heterochromatin Expansion in Rye Chromosomes Evtushenko EV, Levitsky VG, Elisafenko EA, Gunbin KV, Belousov AI, Safar J, Dolezel J, Vershinin AV CYTOGENET GENOME RES, 2016, 148(2-3), 91-91 I.14 , 21st International Chromosome Conference (ICC), Foz do Iguacu, BRAZIL |
|
| Феномен инактивации Х-хромосомы и заболевания человека Шевченко А.И. Гены и клетки, 2016, Том XI. № 2. С. 61-68. |
|
| Профили экспрессии нетранслируемых РНК в центре инактивации у мышевидных грызунов Елисафенко Е.А., Шевченко А.И., Закиян С.М. Гены и клетки, 2016, Том XI. № 2. С. 82-86. |
|
| СРАВНИТЕЛЬНЫЙ АНАЛИЗ ИММУННОГО ОТВЕТА ЛИЧИНОК КОЛОРАДСКОГО ЖУКА ПРИ РАЗВИТИИ МИКОЗОВ, ВЫЗВАННЫХ METARHIZIUM ROBERTSII, M. BRUNNEUM И M. PEMPHIGI М. В. Тюрин, В. Ю. Крюков, О. Н. Ярославцева, Е. А. Елисафенко, И. М. Дубовский, В. В. Глупов Журнал эволюционной биохимии и физиологии, 2016, 2016, Т. 52, №. 3, стр. 252—260 |
|
| Участие LIF-STAT3 каскада в поддержании самообновления и плюрипотентного состояния в клетках крысы Е.А. Васькова, В.В. Шерстюк, С.М. Закиян Гены и клетки, 2016, Т. XI, № 3, С. 47-53 |
|
| Оценка функциональных свойств человеческих эндотелиальных и гладкомышечных клеток после заселения на поверхности из естественных и синтетических материалов Саая Ш.Б., Захарова И.С., Живень М.К., Шевченко А.И., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Закиян С.М. Вестник трансплантологии и искусственных органов, 2016, Т. XVIII. № 3. С. 94-101. |
|
| Разработка тканеинженерных конструкций на основе смеси хитозана и поликапролактона для сосудистой хирургии. Захарова И.С., А.М. Смирнова, М.К. Живень, Ш.Б. Саая, А.И. Шевченко, С.М. Закиян, Е.А., Л.Н. Иванова Гены и клетки, 2016 |
|
| Сравнительный анализ миграционной активности популяций клеток костного мозга в лимфоидные и нелимфоидные органы в норме и на модели экспериментального сахарного диабета Повещенко А.Ф., Миллер Т.В., Лыков А.П., Повещенко О.В., Бондаренко Н.А., Петровская И.Ф., Завьялов Е.Л., Дементьева Е.В., Захарова И.С., Грицык О.Б., Шурлыгина А.В., Коненков В.И. Современные проблемы науки и образования, 2016, №2-0, с.137 |
|
| 2015 | Mapping of Replication Origins in the X Inactivation Center of Vole Microtus levis Reveals Extended Replication Initiation Zone Sherstyuk VV, Shevchenko AI, Zakian SM PloS One, 2015, V. 10. - №6. - P.e0128497. - doi:10.1371/journal.pone.0128497 |
| Индуцированные плюрипотентные стволовые клетки гибридов полёвок Microtus levis × Microtus arvalis: условия, необходимые для получения и поддержания Григорьева Е.В., Шевченко А.И., Медведев С.П., Мазурок Н.А., Железова А.И., Закиян С.М. Acta Naturae, 2015, Т. 7. № 4(27). С. 64-78. |
|
| Терапия хронического кардиосклероза у крыс линии WAG культурами кардиоваскулярных клеток, обогащенными стволовыми клетками сердца Е.В.Чепелева, С.В.Павлова, А.А.Малахова, Е.А.Милевская, Я.Л.Русакова, Н.А.Подхватилина, Д.С.Сергеевичев, Е.А.Покушалов, А.М.Караськов, Г.Т.Сухих, С.М.Закиян Клеточные технологии в биологии и медицине, 2015, № 3, с. 191-201 |
|
| Модельные системы болезней двигательных нейронов – платформа для изучения механизмов патогенеза и поиска терапевтических средств Валетдинова К.Р., Медведев С.П., Закиян С.М. Acta Naturae, 2015, Т.7. №1(24). С. 92-109. |
|
| Инструменты геномной инженерии, предназначенные для создания изогенной модели бокового амиотрофического склероза Валетдинова К.Р., Устьянцева Е.И., Елисафенко Е.А., Жарков Д.О., Тупикин А.Е., Кабилов М.Р., Медведев С.П., Закиян С.М. Медицинская генетика, 2015, Т. 14. № 6 (156). С. 3-9. |
|
| Эктопическая локализация клеток нервного гребня – этиологический фактор сколиотической болезни Зайдман А.М., Строкова Е.Л., Киселева Е.В., Агеева Т. А., Сульдина Л.А., Струнов А. А., Шевченко А.И., Садовой М.А. Хирургия позвоночника, 2015, № 4. Т.12. С. 88-97. |
|
| Transcriptome characteristics and X-chromosome inactivation status in cultured rat pluripotent stem cells Vaskova E.A., Medvedev S.P., Sorokina A.E., Nemudryy A.A., Elisaphenko E.A., Zakharova I.S., Shevchenko A.I., Kizilova E.A., Zhelezova A.I., Evshin I.S., Sharipov R.N., Minina J.M., Zhdanova N.S., Khegay I.I., Kolpakov F.A., Sukhikh G.T., Pokushalov E.A., Karaskov A.M., Vlasov V.V. Ivanova L.N., Zakian S.M. STEM CELLS DEV, 2015, V. 24. No.24. P. 2912-2924. |
|
| Система CRISPR/Cas9 - инструмент для исследования наследственных сердечно-сосудистых заболеваний Медведев С.П., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Т. 19. № 4-2, С. 113-117 |
|
| Применение технологии индуцированных плюрипотентных стволовых клеток для моделирования синдрома удлиненного интервала QT Вялкова А.В., Дементьева Е.В, Медведев С.П., Покушалов Е.А., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, T. 19. № 4-2. С. 85-94. |
|
| Моделирование наследственных кардиомиопатий человека на основе дифференцированных производных индуцированных плюрипотентных стволовых клеток Байзигитов Д.Р., Медведев С.П., Дементьева Е.В., Покушалов Е.А., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Т. 19. № 4-2. С. 95-103. |
|
| Сравнение мезенхимальных стромальных клеток костного мозга и региональных стволовых клеток сердца и фибробластов кожи человека Павлова С.В., Сергеевичев Д.С., Чепелева Е.В., Козырева В.С., Малахова А.А., Захарова И.С., Григорьева Е.В., Покушалов Е.А., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Том 19, № 4-2. С. 12-19. |
|
| Разработка клеточных технологий для создания клеточно-наполненных сосудистых трансплантатов Захарова И.С., Живень М.К., Саая Ш.Б., Шевченко А.И., Струнов А.А., Иванова Л.Н., Карпенко А.А., Покушалов Е.А., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Том 19 №4-2 С. 43-54 |
|
| Гетерогенность клеток эндотелия Живень М.К., Захарова И.С., Шевченко А.И., Покушалов Е.А., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Т. 19. № 4-2. С. 104-112. |
|
| Ангиогенный потенциал кардиальных стволовых и мезенхимальных стромальных клеток костного мозга крысы Павлова С. В., Розанова И.А., Чепелева Е. В., Малахова А. А., Лыков А.П., Покушалов Е.А., Закиян С. М. Патология кровообращения и кардиохирургия, 2015, Т.19, №4-2 77-84 |
|
| Оптимизация протокола интрамиокардиальной трансплантации с использованием люминесценции кардиальных мезенхимальных клеток, маркированных экспрессией люциферазы Милевская Е.А., Немудрый А.А., Чепелева Е. В., Малахова А. А., Павлова С.В., Докучаева А.А., Сергеевичев Д.С., Закиян С.М. Патология кровообращения и кардиохирургия, 2015, Т.19. № 4-2. 2015. С. 69-76. |
|
| Получение культуры клеток из скелетной мускулатуры крысы для применения в клеточной терапии ишемических поражений сердца Чепелева Е. В., Павлова С. В., Малахова А. А., Покушалов Е. А., Закиян С. М. Патология кровообращения и кардиохирургия, 2015, № 4-2. 2015. С. 28-32. |
|
| Разработка и изучение in vitro тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток. Розанова И.А., Повещенко О.В., Карпенко А.А., Павлова С.В., Сергеевичев Д.С., Лыков А.П.,Бондаренко Н.А., Докучаева А.В. Патология кровообращения и кардиохирургия, 2015, Т.19, №4-2 20-27 |
|
| Сравнительное исследование трех типов протезов, изготовленных методом электроспиннинга в эксперименте in vitro и in vivo ПОПОВА И.В. СТЕПАНОВА А.О. СЕРГЕЕВИЧЕВ Д.С. АКУЛОВ А.Е. ЗАХАРОВА И.С. ПОКУШАЛОВ А.А. ЛАКТИОНОВ П.П. КАРПЕНКО А.А. Патология кровообращения и кардиохирургия, 2015, Выпуск № 4 / том 19 / 2015. Стр. 63-71 |
|
| Использование кардиальной культуры клеток КМК-Luc, маркированной экспрессией люциферазы, для оптимизации протокола интрамиокардиальной трансплантации Е.А. Милевская, А.А. Немудрый, Е. В. Чепелева, А. А. Малахова, С. В. Павлова, А. А. Докучаева, Д.С. Сергеевичев, С. М. Закиян Патология кровообращения и кардиохирургия, 2015, Т. 19 (S4-2), С. 69-76 |
|
| 2014 | Клонировать эмбрион человека помог...кофеин Васькова Е.А, Дементьева Е.В. Наука из первых рук, 2014, №1(55), 2014 |
| СИСТЕМЫ РЕДАКТИРОВАНИЯ ГЕНОМОВ TALEN И CRISPR/CAS ИНСТРУМЕНТЫ ОТКРЫТИЙ Немудрый А.А., Валетдинова К.Р., Медведев С.П., Закиян С.М. Acta Naturae, 2014, том 6, № 3(22), с. 20-42 |
|
| Epigenetic landscape for initiation of DNA replication Sherstyuk VV, Shevchenko AI, Zakian SM CHROMOSOMA, 2014, V. 123. № 3. Р. 183-199. doi:10.1007/s00412-013-0448-3 |
|
| Dynamics of the two heterochromatin types during imprinted X chromosome inactivation in vole Microtus levis Vaskova E.A., Dementyeva E.V., Shevchenko A.I., Pavlova S.V., Grigor’eva E.V., Zhelezova A.I., VandeBerg J.L., Zakian S.M. PloS One, 2014, 9(2):e88256 |
|
| 2013 | Структурно-функциональный анализ 5'-регуляторной области гена Nanog полёвки Сорокин М.А., Елисафенко Е.А., Мазурок Н.А., Закиян С.М. Doklady Akademii Nauk, 2013, т. 452, № 1, С. 100-105. |
| Характеристика кардиальных культур клеток, полученных из экспланта сердечной мышцы человека С.В. Павлова, П.П. Перовский, Е.В. Чепелева, А.А. Малахова, Е.В. Дементьева, Е.А. Покушалов, Г.Т. Сухих, С.М. Закиян B EXP BIOL MED+, 2013, №4, C.132-141 |
|
| Характеристика индуцированных плюрипотентных стволовых клеток человека с помощью ДНК-микрочипов Медведев С.П., Сметанина М.А., Шевченко А.И., Захарова И.С., Малахова А.А., Григорьева Е.В., Дементьева Е.В., Александрова М.А., Полтавцева Р.А., Верясов В.Н., Филипенко М.Л., Сухих Г.Т., Закиян С.М. B EXP BIOL MED+, 2013, №1, стр. 3-10 |
|
| Коррекция паталогических изменений межпозвоночного диска методами тканевой инженерии в эксперименте Зайдман А.М., Щелкунова Е.И., Строкова Е.Л., Шевченко А.И., Ластевский А.Д., Рерих В.В. Хирургия позвоночника, 2013, N 1 C. 80-88. |
|
| Активность ориджинов репликации в центре инактивации Х-хромосомы полевки в различных типах клеток. Шерстюк Владимир Владимирович, Шевченко Александр Игоревич, Мазурок Нина Алексеевна, Закиян Сурен Минасович Doklady Akademii Nauk, 2013, т.450, № 5, C. 606-608. |
|
| Эволюционный путь процесса инактивации Х-хромосомы у млекопитающих Шевченко А.И., Захарова И.С., Закиян С.М. Acta Naturae, 2013, Т.5 № 2 (17). C. 18-32. |
|
| Феномен "эпигенетической памяти" индуцированных плюрипотентных стволовых клеток Е.А.Васькова, А.Е.Стекленева, С.П.Медведев, С.М.Закиян Acta Naturae, 2013, том 5 №3(18), стр.19-27 |
|
| СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ 5'-РЕГУЛЯТОРНОЙ ОБЛАСТИ ГЕНА NANOG ПОЛЕВКИ М. А. Сорокин, Е. А. Елисафенко, Н. А. Мазурок, С. М. Закиян Doklady Akademii Nauk, 2013, том 452, № 1,стр.100-105 |
|
| МикроРНК, эволюция и рак. Колесников Н.Н., Титов С.Е., Веряскина Ю.А., Карпинская Е.В., Шевченко C.П., Ахмерова Л.Г., Иванов М.К., Козлов В.В., Елисафенко Е.А., Гуляева Л.Ф., Жимулев И.Ф. Цитология, 2013, №55. С. 159–164 |
|
| ОРГАНИЗАЦИЯ И ЭВОЛЮЦИЯ СУБТЕЛОМЕРНЫХ РАЙОНОВ ХРОМОСОМ РЖИ Евтушенко Е.В., Елисафенко Е.А., Вершинин А.В. Цитология, 2013, N 4.С.230-233 |
|
| 2012 | A regulatory potential of the Xist gene promoter in vole M. rossiaemeridionalis. Orishchenko KE, Pavlova SV, Elisaphenko EA, Sherstyuk VV, Prinz AV, Shevchenko AI, Dementyeva EV, Zakian SM PloS One, 2012, 2012;7(5):e33994. Epub 2012 May 11. |
| ИЗМЕНЕНИЕ ТЕМПЕРАТУРНЫХ ПРЕФЕРЕНДУМОВ ИЗОЛЯТОВ BEAUVERIA BASSIANA В ШИРОТНОМ ГРАДИЕНТЕ СИБИРИ И КАЗАХСТАНА В. Ю. Крюков, О. Н. Ярославцева, Е. А. Елисафенко, П. В. Митьковец, Г. Р. Леднев, Б. А. Дуйсембеков, С. М. Закиян, В. В. Глупов MICROBIOLOGY+, 2012, том 81, No 4, с. 453-459 |
|
| Эпигенетика плюрипотентных клеток Медведев С.П., Покушалов Е.А., Закиян С.М. Acta Naturae, 2012, Т. 4. № 4(15). С. 26-45. |
|
| Трехмерный хондротрансплантат - пластический материал для замещения дефектов костной ткани Зайдман А.М., Щелкунова Е.И., Строкова Е.Л., Корель А.В., Рахматиллаев Ш.Н., Шевченко А.И. Хирургия позвоночника, 2012, № 4. С. 65-72. |
|
| Дозовая компенсация: регуляция экспрессии генов половых хромосом Дементьева Е.В. Vavilov journal of genetics and breeding, 2012, Т. 16. № 3. С. 202-213. |
|
| 2011 | Human induced pluripotent stem cells derived from fetal neural stem cells successfully undergo directed differentiation into cartilage Medvedev S.P., Grigor’eva E.V., Shevchenko A.I., Malakhova A.A., Dementyeva E.V., Shilov A.A., Pokushalov E.A., Zaidman A.M., Aleksandrova M.A., Plotnikov E.Yu., Sukhikh G.T., Zakian S.M. STEM CELLS DEV, 2011, V. 20. № 6. P. 1099-1112. |
| Нарушение клеточного цикла в тимусе и селезенке у самцов мышей под влиянием хронического социального стресса: эффекты диазепама. Кудрявцева Н.Н., Шурлыгина А.В., Мельникова Е.В., Тендитник М.В., Бондарь Н.П., Пантелеева Н.Г., Смагин Д.А., Колесников Н.Н., Труфакин В.А. B EXP BIOL MED+, 2011, 2011 г., Том 151, № 4, 391-394 |
|
| Variability of sequence surrounding the Xist gene in rodents suggests taxon-specific regulation of X chromosome inactivation Shevchenko A.I., Malakhova A.A., Elisaphenko E.A., Mazurok N.A., Nesterova T.B., Brockdorff N., Zakian S.M. PloS One, 2011, V. 6. № 8. e22771 |
|
| Histone H3 trimethylation at lysine 9 marks the inactive metaphase X chromosome in the marsupial Monodelphis domestica Zakharova I.S., Shevchenko A.I., Shilov A.G., Nesterova T.B., Vandeberg J.L., Zakian S.M. CHROMOSOMA, 2011, V. 120. №2. P. 177-183. |
|
| Functional Analysis of the Xist Promoter Region in Mouse Mus musculus A. M. Korotkova, E. A. Elisaphenko, and S. M. Zakian RUSS J GENET+, 2011, Т.47, №1, стр.140-144 |
|
| 2010 | Исследование регуляторной области гена Tsix полевки Microtus rossiaemeridionalis Жукова О.А., Елисафенко Е.А., Закиян С.М. RUSS J GENET+, 2010, Т. 46. № 9. С. 1392-1396. |
| Мейотическая инактивация половых хромосом у млекопитающих Васькова Е.А., Павлова С.В.,Шевченко А.И., Закиян С.М. RUSS J GENET+, 2010, №4, Том 46, 437-447 |
|
| Молекулярные основы поддержания самообновления и плюрипотентности эмбриональных стволовых клеток млекопитающих Медведев С.П., Шевченко А.И., Закиян С.М. Acta Naturae, 2010, Т. 2. № 3(6). С. 38-57 |
|
| Получение индуцированных плюрипотентных стволовых клеток из фибробластов кожи плода человека Медведев С.П., Малахова А.А., Григорьева Е.В., Шевченко А.И., Дементьева Е.В., Соболев И.А., Лебедев И.Н., Шилов А.Г., Жимулев И.Ф., Закиян С.М. Acta Naturae, 2010, № 2(5), Т. 2, С. 108-110 |
|
| Равенство полов по Х-хромосоме Павлова С.В., Шевченко А.И., Закиян С.М. Природа, 2010, № 1. С. 22-28. |
|
| Роль замены G(-43)A в промоторном районе гена Xist при неслучайной инактивации Х-хромосомы у межвидовых гибридов обыкновенных полевок Орищенко К.Е. , Елисафенко Е.А., Закиян С.М. RUSS J GENET+, 2010, т.46, № 10, с. 1397-1400. |
|
| Сравнительная организация и происхождение некодирующих регуляторных РНК генов центра инактивации Х-хромосомы человека и мыши Колесников Н. Н. и Елисафенко Е. А. RUSS J GENET+, 2010, Т. 46. № 9. С. 1386-1391. |
|
| Сравнительный анализ регуляторного района DXPas34 грызунов Малахова А.А., Пяткова М.С., Елисафенко Е.А., Шевченко А.И., Кель А.Э., Закиян С.М. RUSS J GENET+, 2010, № 10, С. 1236-1239. |
|
| Экзон-интронная структура гена Xist слона, броненосца и предка плацентарных млекопитающих Колесников Н. Н. и Елисафенко Е. А. RUSS J GENET+, 2010, Т. 46. № 9. С. 1379- 1385. |
|
| Экспрессия генов раннего развития у полевки Microtus rossiaemeridionalis Сорокин М.А., Медведев С.П., Шевченко А.И., Слынько Н.М., Закиян С.М. RUSS J GENET+, 2010, Т. 46. № 2. С. 282-286. |
|
| Difference between random and imprinted X inactivation in common voles E.V. Dementyeva, A.I. Shevchenko, O.V. Anopriyenko, N.A. Mazurok, E.A. Elisaphenko, T.B. Nesterova, N. Brockdorff, S.M. Zakian. CHROMOSOMA, 2010, V. 119, № 5. P. 541-552. |
|
| Стволовые клетки, участвующие в образовании внезародышевых тканей. Е.В.Григорьева, А.И.Шевченко, А.И.Железова, А.Г.Шилов, Н.А.Мазурок, П.А.Дыбан, А.П.Дыбан, С.М.Закиян. Клеточные технологии в биологии и медицине, 2010, №4, с.183-194 |
|
| Взаимное расположение двух семейств тандемных повторов в гетерохроматине ржи Евтушенко Е.В., Елисафенко Е.А., Вершинин А.В. Molecular Biology, 2010, Т.44, №1, с.5-12 |
|
| Дозовая компенсация генов половых хромосом у эукариот Дементьева Е.В., Закиян С.М. Acta Naturae, 2010, № 4(7), Т. 2, С. 6-14 |
|
| Изучение молекулярного состава прицентромерного гетерохроматина хромосомы 2 малярийных комаров (Diptera, Culicidae) Сайджафарова А. О., Елисафенко Е. А., Стегний В. Н. RUSS J GENET+, 2010, Т. 46. № 9, С. 1307-1310. |
|
| Индуцированные плюрипотентные стволовые клетки: проблемы и перспективы применения в заместительной клеточной терапии Медведев С.П., Шевченко А.И., Закиян С.М. Acta Naturae, 2010, Т. 2. № 2(5). С. 18-28. |
|
| 2009 | Молекулярно-генетическая организация и особенности экспрессии гена Nanog у полевки Microtus rossiaemeridionalis С.П. Медведев, Е.А.Елисафенко, А.И. Шевченко, Н.А. Мазурок, С.М. Закиян Doklady Biochemistry and Biophysics, 2009, т.425, №5, с.688-691 |
| Молекулярно-генетическая характеристика регуляторного района гена xist полевки microtus rossiaemeridionalis К. Е. Орищенко, Е. А. Елисафенко, А. Э. Кель, С. М. Закиян RUSS J GENET+, 2009, 10, 45, 1341-1352 |
|
| FGF4 independent derivation of trophoblast stem cells from the common vole Grigor'eva EV, Shevchenko AI, Mazurok NA, Elisaphenko EA, Zhelezova AI, Shilov AG, Dyban PA, Dyban AP, Noniashvili EM, Slobodyanyuk SY, Nesterova TB, Brockdorff N, Zakian SM PloS One, 2009, 4(9): e7161. |
|
| Monoallelic gene expression in mammals Zakharova IS, Shevchenko AI, Zakian SM CHROMOSOMA, 2009, V. 118. №3. Р. 279-290. |
|
| Mosaic heterochromatin of the inactive X chromosome in vole Microtus rossiaemeridionalis A.I. Shevchenko, S.V.Pavlova, E.V. Dementyeva, S.M. Zakian. MAMM GENOME, 2009, № 9-10, V. 20, P. 644-653 |
|
| X-chromosome upregulation and inactivation two sides of the dosage compensation mechanism in mammals E.V. Dementyeva, A.I. Shevchenko, S.M. Zakian. BIOESSAYS, 2009, № 1, V. 31, P. 21-28. |
|
| Индуцированные плюрипотентные стволовые клетки А.И. Шевченко, С.П. Медведев, Н.А. Мазурок, С.М. Закиян RUSS J GENET+, 2009, т.45, №2, с.160-168. |
|
| 2008 | Линии стволовых клеток экстраэмбриональной эндодермы обыкновенных полевок рода Microtus А. И. Шевченко, В. В.Демина, Н. А. Мазурок, А. И. Железова, Я. Р. Ефремов, А. Г. Шилов, А. И. Шевела, А. В. Белеванцева, В. В. Власов, С. М. Закиян RUSS J GENET+, 2008, Т. 44. N 11. С. 1477-1485 |
| Реконструкция предкового гена XIST и пути его эволюции у млекопитающих Елисафенко Е. А., Колесников Н.Н., Шевченко А. И., Закиян С. М. Информационный вестник ВОГИС, 2008, № 1, Том 12, 186-196 |
|
| A Dual Origin of the Xist Gene from a Protein-Coding Gene and a Set of Transposable Elements E.A. Elisaphenko, N.N. Kolesnikov, A.I. Shevchenko, I.B. Rogozin, T.B. Nesterova, N. Brockdorff, S.M. Zakian PloS One, 2008, Jun 25;3(6):e2521 |
|
| Oct4 и Nanog – ключевые гены в системе поддержания плюрипотентности клеток млекопитающих Медведев С.П., Шевченко А.И., Мазурок Н.А., Закиян С.М. RUSS J GENET+, 2008, Т 44. № 12. С. 1589-1608. |
|
| Structure and expression pattern of Oct4 gene are conserved in vole Microtus rossiaemeridionalis Medvedev SP, Shevchenko AI, Elisaphenko EA, Nesterova TB, Brockdorff N, Zakian SM. BMC GENOMICS, 2008, V. 9. N 162. doi:10.1186/1471-2164-9-162 |
|
| 2007 | СТРУКТУРА И ЭВОЛЮЦИЯ ГЕНА MaSMC4 ПОЛЕВКИ Microtus arvalis (Arvicolidae, Rodentia) С. В. Павлова, Е. А. Елисафенко, С. М. Закиян RUSS J GENET+, 2007, том 43, № 2, С. 159-169 |
| DNA content of the B chromosomes in grasshopper Podisma kanoi Storozh. (Orthoptera, Acrididae) Bugrov AG, Karamysheva TV, Perepelov EA, Elisaphenko EA, Rubtsov DN, Warchalowska-Sliwa E, Tatsuta H, Rubtsov NB CHROMOSOME RES, 2007, 15(3):315-25 |
|
| Genes flanking Xist in mouse and human are separated on the X chromosome in American marsupials Shevchenko AI, Zakharova IS, Elisaphenko EA, Kolesnikov NN, Whitehead S, Bird C, Ross M, Weidman JR, Jirtle RL, Karamysheva TV, Rubtsov NB, Vandeberg JL, Mazurok NA, Nesterova TB, Brockdorff N, Zakian SM CHROMOSOME RES, 2007, V. 15. N. 2. P. 127-136. |
|
| The structure and evolution of the MaSMC4 gene of common vole Microtus arvalis (Arvicolidae, Rodentia) Pavlova SV, Elisafenko EA, Zakiian SM RUSS J GENET+, 2007, 43,2,159-169 |
|
| 2006 | Модификации хроматина в процессе инактивации Х-хромосомы у самок млекопитающих Шевченко А.И., Павлова С.В., Дементьева Е.В., Голубева Д.В., Закиян С.М. RUSS J GENET+, 2006, № 9, Т. 42, C. 1225-1234 |
| Эпигенетика специфических районов хромосом А.В.Вершинин RUSS J GENET+, 2006, т.42, №9, стр. 1200-1214 |
|
| Novel genes identified by manual annotation and microarray expression analysis in the pancreas Mazzarelli J.M., White P., Gorski R., Brestelli J., Pinney D.F., Arsenlis A., Katokhin A., Belova O., Bogdanova V., Elisafenko E., Gubina M., Nizolenko L., Perelman P., Puzakov M., Shilov A., Trifonoff V., Vorobjeva N., Kolchanov N., Kaestner K.H., Stoeck GENOMICS, 2006, V. 88, № 6, P. 752-761. |
|
| Памяти Л.И. Корочкина Жимулёв И.Ф., Васильева Л.А., Закиян С.М. Информационный вестник ВОГИС, 2006, Т. 10. № 3. С. 604-607. |
 Монографии
Монографии
| 2021 | The Gene and Repetitive Element Landscape of the Rye Genome Alexander V. Vershinin, Thomas Lux, Heidrun Gundlach, Evgeny A. Elisafenko, Jens Keilwagen, Klaus F. X. Mayer, and Manuel Spannagl |
| 2020 | Создание трансгенных индуцированных плюрипотентных стволовых клеток, предназначенных для изучения молекулярно-генетических механизмов патогенеза болезни Паркинсона Шарипова Д.В., Байрамова Э.М., Коваленко В.Р., Закиян С.М., Медведев С.П. |
| Внесение трансгенов в safe-harbor локус AAVS1 генома
индуцируемых плюрипотентных стволовых клеток с помощью рибонуклеопротеиновых комплексов Устьянцева Елизавета Ивановна |
|
| Внесение протяженных трактов тринуклеотидных повторов в геном человека для моделирования болезни Хантингтона in vitro Малахова А.А., Маланханова Т.Б., Сорокин А.А. |
|
| 2018 | Глава 22. Применение системы CRISPR/Cas9 для создания и исследования клеточных моделей наследственных и приобретенных заболеваний человека Валетдинова К.Р. |
| Глава 9. Актуальные проблемы при редактировании генома: доставка ZFN, TALEN, CRISPR/Cas9 и низкая эффективность гомологичной рекомбинации Маланханова Т.Б., Валетдинова К.Р. |
|
| Внесение протяженных трактов тринуклеотидных повторов в геном клеток человека для моделирования болезни Хантингтона in vitro Малахова А.А., Маланханова Т.Б., Сорокин М.А. |
|
| Глава 21. Использование искусственных нуклеаз TALEN для модификации геномов культивируемых клеток человека Маланханова Т.Б. |
|
| том 3, глава 33 "Получение делеции INT6/EIF3E в индуцированных плюрипотентных стволовых клетках человека с помощью системы редактирования генома CRISPR/Cas9" Живень М. К., Захарова И. С., Смирнова А. М., Шевченко А.И., Елисафенко Е.А., Закиян С.М. |
|
| 2017 | Models of Hereditary Neurodegenerative, Neurological, and Psychiatric Diseases Based on Induced Pluripotent Stem Cell-Derived Neurons S.P. Medvedev, S.M. Zakian |
| 2016 | Глава 9. Применение системы CRISPR/Cas9 для создания и исследования клеточных моделей наследственных и приобретенных заболеваний человека. Валетдинова К.Р. |
| Глава 13. Актуальные проблемы при редактировании генома: доставка ZFN, TALEN, CRISPR/Cas9 и низкая эффективность гомологичной рекомбинации. Маланханова Т.Б., Валетдинова К.Р. |
|
| Система CRISPR/Cas9 - инструмент "обратной" геномики Медведев С.П., Закиян С.М. |
|
| Глава 5. Использование искусственных нуклеаз TALEN для модификации геномов культивируемых клеток человека Маланханова Т.Б. |
|
| Система CRISPR/Cas9 как инструмент для создания новых модельных систем на основе лабораторных животных Шерстюк В.В. |
|
| 2014 | Индуцированные плюрипотентные стволовые клетки, - 2-е издание, расширенное и дополненное. С.П. Медведев, А.И. Шевченко, Г.Т. Сухих, С.М. Закиян |
| 2013 | Evolution of X Chromosome Inactivation Shevchenko AI, ZakianSM |
| 2012 | Структура и функционирование центра инактивации Х-хромосомы млекопитающих Малахова А.А., Шевченко А.И., Елисафенко Е.А., Павлова С.В., Закиян С.М. |
| Эволюция и организация кластеров генов с импринтированной моноаллельной экспрессией Короткова А.М., Захарова И.С. |
|
| Мейотическая инактивация половых хромосом. Васькова Е.А., Шевченко А.И., Павлова С.В., Закиян С.М. |
|
| Модификации хроматина в процессе инактивации Х-хромосомы у самок млекопитающих. Павлова С.В., Дементьева Е.В., Шевченко А.И. |
|
| Регуляция экспрессии генов Х-хромосомы у млекопитающих Дементьева Е.В., Шевченко А.И., Закиян С.М. |
|
| Стволовые клетки Григорьева Е.В., Шевченко А.И., Мазурок Н.А., Покушалов Е.А., Закиян С.М. |
|
| Эпигенетические механизмы в регуляции самообновления и плюрипотентности клеток млекопитающих Медведев С.П., Покушалов Е.А., Закиян С.М. |
|
| Эволюция процесса инактивации Х-хромосомы. Елисафенко Е.А., Колесников Н.Н., Шевченко А.И., Закиян С.М. |
|
| Генетические и эпигенетические механизмы предымплантационного развития мыши. Сорокин Михаил Алексеевич |
|
| 2011 | Индуцированные плюрипотентные стволовые клетки Медведев С.П., Шевченко А.И., Сухих Г.Т.,Закиян С.М. |
 Конференции
Конференции
| 2024 | Влияние генетических вариантов с неясным клиническим значением в генах саркомерных белков на развитие гипертрофической кардиомиопатии на модели кардиомиоцитов, дифференцированных из изогенных линий индуцированных плюрипотентных стволовых клеток, полученных с помощью системы редактирования CRISPR/Cas9 Павлова С.В., Шульгина А.Е., Закиян С.М., Дементьева Е.В. VI Национальный конгресс по регенеративной медицине |
| Клеточные модели нейродегенеративных заболеваний для изучения патологических процессов в нейронах при протеинопатиях Малахова А.А., Макеева В.С., Капитошина Е.В., Аллаярова Э.Р., Дырхеева Н.С.Григорьева Е.В., Медведев С.П., Лаврик О.И., Закиян С.М. VI Национальный конгресс по регенеративной медицине |
|
| Влияние ингибиторов PARP1 на развитие патологических процессов в нейральных производных, дифференцированных из ИПСК пациентов с болезнью Хантингтона Макеева В.С., Малахова А.А., Дырхеева Н.С., Закиян С.М. VI Национальный конгресс по регенеративной медицине |
|
| Влияние вариантов c.1977G>A в гене MYH7 и c.1543_1545delAAC в гене MYBPC3 на развитие гипертрофической кардиомиопатии Шульгина А., Павлова С., Проняева К., Закиян С., Дементьева Е. 14-я Международная мультиконференция «Биоинформатика регуляции и структуры геномов / системная биология» / 14th International Multiconference on “Bioinformatics of Genome Regulation and Structure/Systems Biology”, BGRS/SB-2024. |
|
| Установление клинического значения вариантов в генах, ассоциированных с гипертрофической кардиомиопатией, с использованием технологии индуцированных плюрипотентных стволовых клеток и системы редактирования CRISPR/Cas9 Дементьева Е.В. Ежегодная всероссийская научно-практическая конференция "Кардиология на марше 2024" |
|
| Формирование многослойных мембран ЭПР и их атипичное слияние с ядерной оболочкой в мутантных клетках HEK293, содержащих 150 CAG-повторов в гене хантингтина Киселева Е.В., Сульдина Л.А., Григорьева Е.В., Морозова К.Н. XIX Всероссийский симпозиум «Структура и функции клеточного ядра» |
|
| Активация процесса партанатоса в нейронах, дифференцированных из ИПСК пациентов с нейродегенеративными заболеваниями А.А.Малахова, В.С.Макеева, Е.В.Капитошина, Е.В.Григорьева, С.В.Павлова, С.П.Медведев, С.М.Закиян Международный Конгресс «VIII Съезд Вавиловского общества генетиков и селекционеров» |
|
| Направленное редактирование геномов индуцированных плюрипотентных стволовых клеток человека как инструмент функционального анализа генетических вариантов Медведев С.П., Ахмерова В.И., Надточий Ю.А., Григорьева Е.В., Павлова С.В., Закиян С.М. Научные чтения, посвященные 60-летию кафедры генетики и клеточной биологии Томского государственного университета |
|
| 2023 | Исследование наследственных сердечно-сосудистых заболеваний человека с помощью клеточных и
геномных технологий Дементьева Е.В. II Международный форум геномных и биомедицинских технологий "От рождения до активного долголетия" |
| Влияние генетического варианта c.1977G>A (p.M659I) в гене MYH7 с неясным клиническим значением
на морфологию кардиальных производных индуцированных плюрипотентных клеток Шульгина А.Е., Павлова С.В., Закиян С.М., Дементьева Е.В. конгресс "CRISPR-2023" |
|
| Роль генетического варианта p.Asn515del в гене MYBPC3 в формировании патологического фенотипа
кардиомиоцитов in vitro Проняева К.А., Павлова С.В., Закиян С.М., Дементьева Е.В. конгресс “CRISPR-2023” |
|
| Исследование влияния генетических вариантов с неясным клиническим значением на развитие гипертрофической кардиомиопатии с помощью индуцированных плюрипотентных стволовых клеток и системы редактирования CRISPR/Cas9 Дементьева Е.В. VI инновационный петербургский медицинский форум |
|
| Ультраструктурная организация индуцированных плюрипотентных стволовых клеток человека с увеличенным числом CAG повторов в гене хантингтина, использующихся для создания клеточных моделей болезни Хантингтона. Сульдина Л.А., Морозова К.Н., Малахова А.А., Лагарькова М.А., Киселева Е.В. XX Всероссийская молодежная школа-конференция по актуальным проблемам химии и биологии, ТИБОХ ДВО РАН. Владивосток, 4-8 сентября 2023 |
|
| Клеточные модели нейродегенеративных заболеваний до всемирного CRISPR-потопа и после Медведев С.П. Международный конгресс "CRISPR-2023" |
|
| Клеточная платформа на основе ИПСК, полученных от пациентов с болезнью Паркинсона для изучения влияния патогенного варианта T1492G гена GLUD2 на фенотип нейральных производных Сорогина Д.А., Шубкин А.В., Григорьева Е.В., Павлова С.В., Яркова Е.С., Медведев С.П., Малахова А.А., Закиян С.М. CRISPR-2023 |
|
| Клеточные модели, демонстрирующие влияние генетических вариантов гена GBA на развитие болезни Паркинсона Яркова Е.С., Григорьева Е.В., Павлова С.В., Сорогина Д.А., Копытова А.Е., Байдакова Г.В., Захарова Е.Ю., Пчелина С.Н., Закиян С.М. CRISPR-2023 |
|
| Роль поли(АДФ-рибоза) полимеразы I в развитии нейродегенеративных заболеваний Малахова А.А., Макеева В.С., Капитошина Е.В., Григорьева Е.В., Павлова С.В., Медведев С.П., Закиян С.М. CRISPR-2023 |
|
| Новые фармакологические шапероны глюкоцереброзидазы – таргетная терапия болезни Паркинсона Пчелина С.Н., Копытова А.Э., Рычков Г.Н., Ибатуллин Ф.М., Григорьева Е.В., Николаев М.А., Изюмченко А.Д., Байдакова Г.В., Павлова С.В., Яркова Е.С., Сорогина Д.А., Захарова Е.Ю., Емельянов А.К. CRISPR-2023 |
|
| Ингибирование киназной активности LRRK2 влияет на функцию глюкоцереброзидазы в дофаминергических нейронах, дифференцированных из индуцированных плюрипотентных стволовых клеток пациентов с болезнью паркинсона, ассоциированной с мутациями в генах LRRK2 и GBA1 Усенко Т.С., Башарова К.С., Безрукова А.И., Григорьева Е.В., Павлова С.В., Байдакова Г.В., Медведев С.П., Милюхина И.В., Захарова Е.Ю., Пчелина С.Н. CRISPR-2023 |
|
| Разработка клеточных моделей, демонстрирующих молекулярный фенотип болезни Паркинсона, вызванной мутациями в гене GBA1 Яркова Е.С., Григорьева Е.В., Павлова С.В., Сорогина Д.А., Копытова А.Е., Байдакова Г.В., Захарова Е.Ю., Пчелина С.Н., Закиян С.М. Сборник материалов конференции «Геномный анализ и генетическая модификация клеток» |
|
| 2022 | Подход к изучению протеинопатий, вызванных экспрессией мутантного белка Хантингтин А.А. Малахова, В.С. Макеева, С.П. Медведев, С.М. Закиян V Национальный конгресс по регенеративной медицине |
| Использование геномных и клеточных технологий для выяснения клинического значения мутаций в генах, ассоциированных с гипертрофической кардиомиопатией Дементьева Е.В., Павлова С.В., Шульгина А.Е., Проняева К.А., Закиян С.М. V Национальный конгресс по регенеративной медицине |
|
| Моделирование гипертрофической кардиомиопатии с помощью направленной дифференцировки ИПСК с мутацией p.Asn515del в гене MYBPC3 в кардиомиоциты in vitro Проняева К.А., Шаяхметова Л.Ш., Дементьева Е.В., Павлова С.В. V Национальный конгресс по регенеративной медицине |
|
| Применение клеточных технологий для исследования генетических вариантов с неясным клиническим значением в генах, ассоциированных с развитием гипертрофической кардиомиопатии Дементьева Е.В. Симпозиум «Клеточные технологии для решения актуальных задач биологии и медицины» |
|
| Development of a cell model of GBA associated Parkinson's disease for in vitro drug testing Drozdova E., Grigor’eva E., Pavlova S., Malakhova A., Sorogina D., Ibatullin F., Emelyanov A., Pchelina S., Medvedev S., Zakian S. RUSNEUROCHEM 2022: Всероссийская с международным участием конференция Российского нейрохимического общества |
|
| Obtaining and directed differentiation into astroglial and neuronal derivatives of iPSCs from Parkinson's disease patients associated with the GLUD2 mutation Sorogina D., Grigor’eva E., Pavlova S., Drozdova E., Medvedev S., Zakian S. RUSNEUROCHEM 2022: Всероссийская с международным участием конференция Российского нейрохимического общества |
|
| NCGC607 chaperone binds to the mutant glucocerebrosidase in allosteric sites and restores its activity in primary macrophages and IPSC-derived dopaminergic neurons from patients with Parkinson’s disease Kopytova A., Rychkov G., Grigoreva E., Cheblokov A., Pavlova S., Sorogina D., Drozdova E., Nikolaev M., Izymchenko A., Bogdanova D., Ibatullin F., Baydakova G.5, Miliukhina I., Medvedev S., Zakian S., Zakharova E., Pchelina S., Emelyanov A. RUSNEUROCHEM 2022: Всероссийская с международным участием конференция Российского нейрохимического общества |
|
| Направленное редактирование геномов индуцированных плюрипотентных стволовых клеток человека для создания моделей наследственных болезней Медведев С.П., Устьянцева Е.И., Григорьева Е.В., Павлова С.В., Малахова А.А., Закиян С.М. Всероссийская конференция "Синтетическая биология и биофармацевтика" |
|
| Получение генетически модифицированных иПСК с повышенной экспрессией TNFAIPЗ Шевелева О.Н., Ненашева Т.А., Буторина Н.Н., Медведев С.П., Григорьева Е.В., Протасова Е.А., Лядова И.В. Всероссийская школа-конференция «Коллекции культур клеток человека и животных: современные вызовы и сетевые решения» |
|
| Таргетная терапия болезни Паркинсона, ассоциированной с мутациями в гене LRRK2 Усенко Т.С., Башарова К.С., Безрукова А.И., Григорьева Е.В., Байдакова Г.В., Николаев М.А., Павлова С.В., Милюхина И.В., Медведев С.П., Захарова Е.Ю., Закиян С.М., Пчелина С.Н. III ОБЪЕДИНЕННЫЙ НАУЧНЫЙ ФОРУМ ФИЗИОЛОГОВ, БИОХИМИКОВ И МОЛЕКУЛЯРНЫХ БИОЛОГОВ |
|
| Мутация в гене GLUD2 приводит к снижению количества активных митохондрий в нейральных производных ИПСК пациента с болезнью Паркинсона Д.А. Сорогина, Е.С. Дроздова, Е.В. Григорьева, С.В. Павлова, А.А. Малахова, С.П. Медведев, С.М. Закиян. V Национальный конгресс по регенеративной медицине |
|
| Клеточная модель для изучения молекулярно-генетических механизмов болезни Паркинсона, ассоциированной с мутацией в гене GBA Е.С. Дроздова, Е.В. Григорьева, С.В. Павлова, С.П. Медведев, Д.А. Сорогина, А.Е. Копытова, Г.В. Байдакова, Е.Ю. Захарова, С.Н. Пчелина, С.М. Закаян. V Национальный конгресс по регенеративной медицине |
|
| An increase in the number of CAG repeats in the huntingtin
gene enhances pathological ultrastructural aberrations
in the cells and neurons Suldina L.A., Morozova K.N., Malankhanova T.B., Kiseleva E. BIOINFORMATICS OF GENOME REGULATION AND STRUCTURE/SYSTEMS BIOLOGY (BGRS/SB-2022) Novosibirsk, 04–08 июля 2022 года |
|
| Атипичные нейроны с высокой плотностью расположения дефектных шипиков в популяции нейронов с 69 CAG повторами в гене хантингтина Сульдина Л.А., Морозова К.Н., Маланханова Т.Б., Киселева Е.В. XXIX Российская конференция по электронной микроскопии |
|
| Индуцированные плюрипотентные стволовые клетки как источник для получения клеток врождённого иммунитета человека Лядова И.В., Ненашева Т.А., Шевелева О.Н., Григорьева Е.В., Медведев С.П. V Национальный конгресс по регенеративной медицине |
|
| Получение и характеристика макрофагов человека с индуцибельной экспрессией гена TNFAIP3 Шевелева О.Н., Протасова Е.А., Ненашева Т.А., Буторина Н.Н., Медведев С.П., Григорьева Е.В., Мельникова В.И., Лядова И.В. V Национальный конгресс по регенеративной медицине |
|
| Новые фармакологические шапероны в восстановлении активности глюкоцереброзидазы на пациент-специфичных клетках Копытова А.Э., Николаев М.А., Григорьева Е.В., Байдакова Г.В., Изюмченко А.Д., Павлова С.В., Дроздова (Яркова) Е.С., Сорогина Д.А., Милюхина И.В., Безруких В.А., Салогуб Г.Н., Захарова Е.Ю., Пчелина С.Н., Емельянов А.К. IX Всероссийский молодежный научный форум с международным участием “Open Science 2022” |
|
| 2021 | Development of induced pluripotent stem cell-based models of patients with familial hypercholesterolemia for studying the molecular genetic basis of atherosclerosis Zakharova I.S. Семинар с международным участием «Современные методы создания и функциональной оценки иПК», Санкт-Петербург |
| Hypertrophic cardiomyopathy modelling using induced pluripotent stem cells Dementyeva E.V. Семинар с международным участием «Современные методы создания и функциональной оценки иПК» |
|
| Generating and studying cell models of hypertrophic cardiomyopathy Dementyeva E.V., Pavlova S.V., Vyatkin Yu.V., Medvedev S.P., Zakian S.M. Российская конференция с международным участием «Экспериментальная и компьютерная биомедицина» памяти чл.-корр. РАН В.С. Мархасина |
|
| A platform for creating relevant models of hereditary diseases using human induced pluripotent stem cells and the CRISPR-Cpf1 system Malankhanova T., Paulissen A., Valetdinova K., Medvedev S. 45th FEBS Congress |
|
| Application of isogenic stem cell derived motor neurons modified with genetically-encoded biosensors for Amyotrophic lateral sclerosis modeling Ustyantseva E., Zakian S., Medvedev S. 45th FEBS Congress |
|
| Модели заболеваний моторных нейронов на основе
индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Закиян С.М. I Международный форум геномных и биомедицинских технологий "От рождения до активного долголетия" |
|
| Разработка клеточной модели для тестирования in vitro фармакологических препаратов для терапии болезни Паркинсона, ассоциированной с мутацией в гене GBA Дроздова Е.С., Сорогина Д.А., Ибатуллин Ф.М., Емельянов А.К., Пчелина С.Н., Григорьева Е.В. I Международный форум геномных и биомедицинских технологий "От рождения до активного долголетия" |
|
| Получение и направленная дифференцировка в астроглиальные и нейрональные производные ИПСК пациентов с мутацией в гене GLUD2, ассоциированной с болезнью Паркинсона Сорогина Д.А., Дроздова Е.С., Григорьева Е.В. I Международный форум геномных и биомедицинских технологий "От рождения до активного долголетия" |
|
| 2020 | Клеточные модели для тестирования генотерапевтических препаратов Медведев С.П. BiotechClub 2020 |
| Получение клеточной модели для изучения гипертрофической кардиомиопатии Дементьева Е.В., Закиян С.М. V Всероссийская научно-практическая конференция «Фундаментальные и прикладные проблемы здоровьесбережения человека на Севере» |
|
| Редактирование геномов индуцированных
плюрипотентных стволовых клеток для создания новых моделей наследственных болезней человека Медведев С.П., Закиян С.М. V Всероссийская научно-практическая конференция «Фундаментальные и прикладные проблемы здоровьесбережения человека на Севере» |
|
| Индуцированные плюрипотентные стволовые клетки,
редактирование геномов и генетически кодируемые биосенсоры: синтез технологий для решения биомедицинских задач Медведев С.П. VII МОЛОДЁЖНАЯ ШКОЛА-КОНФЕРЕНЦИЯ по молекулярной и клеточной биологии Института цитологии РАН |
|
| Получение и характеристика клеточной модели гипертрофической кардиомиопатии Дементьева Е.В. Ежегодная Всероссийская научно-практическая конференция «Кардиология на марше!» и 60-я сессия, посвященные 75-летию ФГБУ «НМИЦ кардиологии» Минздрава России |
|
| Electron microscopy analysis of autophagy in neurons with expanded CAG repeats in the huntingtin gene investigated at patient-specific and transgenic models Suldina L.A., Morozova K.N., Malankhanova T.B., Malakhova A.A., Kiseleva E. MOLECULAR MECHANISMS OF AUTOPHAGY IN DISEASES |
|
| 2019 | Исследование мутантного фенотипа изогенной клеточной модели болезни Хантингтона Маланханова Т.Б., Григорьева Е.В., Сульдина Л.А., Морозова К.Н., Киселева Е.В., Закиян С.М., Малахова А.А. IV Национальный конгресс по регенеративной медицине |
| Перспективы использования кардиомиоцитов, полученных из индуцированных плюрипотентных стволовых клеток человека, в заместительной клеточной терапии повреждений миокарда Павлова С.В., Чепелева Е.В., Дементьева Е.В., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| Development of the stem cell-based platform for studying the neurodegeneration mechanisms using genetically-encoded biosensors Elizaveta Ustyantseva, Sergey Medvedev, Suren Zakian Precision Health: Molecular Basis, Technology and Digital Health |
|
| Клеточная платформа для поиска и тестирования
антипаркинсонических лекарственных препаратов Медведев С.П. BiotechClub-2019 |
|
| Перспективы использования кардиальных производных индуцированных плюрипотентных стволовых клеток в заместительной клеточной терапии повреждений миокарда Павлова С.В. «Современная кардиология: базовые принципы и прогресс», посвященная 90-летию академика Евгения Ивановича Чазова, 5-7 июня 2019 г., Москва |
|
| Тестирование систем CRISPR/Cas на плюрипотентных клетках крысы Шерстюк В.В., Давлетшина Г.И., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| Разработка системы визуализации экспрессии гена GFAP — специфического маркера астроцитов Авдеев А.А., Григорьева Е.В., Павлова С.В., Медведев С.П., Малахова А.А., Закиян С.М. VI Национальный конгресс по регенеративной медицине |
|
| Создание трансгенных индуцированных плюрипотентных стволовых клеток, предназначенных для изучения молекулярно-генетических механизмов патогенеза болезни Паркинсона и тестирования перспективных лекарственных соединений Медведев С.П., Байрамова Э.М., Шарипова Д.В., Коваленко В.Р., Григорьева Е.В., Закиян С.М. VI Национальный конгресс по регенеративной медицине |
|
| Моделирование и изучение механизмов развития болезни хантингтона на линиях плюрипотентных стволовых клеток человека Малахова А.А., Маланханова Т.Б., Григорьева Е.В., Сульдина Л.А., Морозова К.Н., Киселева Е.В., Закиян С.М. Международный конгресс «VII съезд Вавиловского общества генетиков и селекционеров, посвященный 100-летию кафедры генетики СПбГУ, и ассоциированные симпозиумы» |
|
| Создание клеточной платформы для исследования механизмов нейродегенерации с помощью генетически-кодируемых биосенсоров Елизавета Ивановна Устьянцева, Сергей Петрович Медведев, Сурен Минасович Закиян IV Национальный конгресс по регенеративной медицине |
|
| Создание модели гипертрофической кардиомиопатии с использованием пациент-специфичных индуцированных плюрипотентных стволовых клеток Дементьева Е.В. «Современная кардиология: базовые принципы и прогресс», посвященная 90-летию академика Евгения Ивановича Чазова |
|
| Создание модели гипертрофической кардиомиопатии на основе пациент-специфичных индуцированных плюрипотентных стволовых клеток Дементьева Е.В., Коваленко В.Р., Вяткин Ю.В., Кретов Е.И., Слотвицкий М.М., Медведев С.П., Штокало Д.Н., Покушалов Е.А., Закиян С.М. Российский национальный конгресс кардиологов 2019 |
|
| Исследование динамики потоков ионов кальция в кардиомиоцитах, полученных при дифференцировке индуцированных плюрипотентных стволовых клеток пациентов с гипертрофической кардиомиопатией Дементьева Е.В., Слотвицкий М.М., Вяткин Ю.В., Кретов Е.И., Коваленко В.Р.. Медведев С.П., Штокало Д.Н., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| Современные подходы в изучении нейродегенеративных заболеваний in vitro Григорьева Е.В, Маланханова Т.Б., Павлова С.В., Устьянцева Е.И., Медведев С.П., Малахова А.А., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| Макрофаги, полученные из индуцированных плюрипотентных стромальных клеток, как модель для изучения тканевых резидентных макрофагов Ненашева Т.А., Сердюк Я.В., Герасимова Т.П., Николаев А.А., Григорьева Е.В., Лядова И.В. IV Национальный конгресс по регенеративной медицине |
|
| Human macrophages derived from induced pluripotent stem cells express M1/M2 combined phenotype similar to alveolar macrophages, are phagocytic and able to restrict mycobacterial growth Nenasheva Т., Serdyuk Y., Grigorieva E., Nikolaev A., Lyadova I. 17-th International Congress of Immunology |
|
| Разработка клеточных технологий для регенерации сосудов Захарова И.С., Живень М.К., Ступникова А.С., Шевченко А.И., Закиян С.М Х НАУЧНЫЕ ЧТЕНИЯ, ПОСВЯЩЕННЫЕ ПАМЯТИ АКАДЕМИКА РАМН Е.Н. МЕШАЛКИНА |
|
| Подходы к повышению регенеративного потенциала эндотелиальных клеток Захарова И.С., Живень М.К., Смирнова А.М., Шевченко А.И., Орищенко К.Е., Елисафенко Е.А., Закиян С.М. «Современная кардиология: базовые принципы и прогресс», посвященная 90-летию академика Евгения Ивановича Чазова |
|
| Модуляция экспрессии гена HIF-2a в плюрипотентных стволовых клетках человека с использованием системы CRISPR/Cas9 Живень М.К., Захарова И.С., Смирнова А.М., Орищенко К.Е., Шевченко А.И., Елисафенко Е.А., Закиян С.М. VI Международная конференция молодых ученых: биофизиков, биотехнологов, молекулярных биологов и вирусологов Open Bio |
|
| Разработка подходов к клиническому применению васкулярных клеток в регенеративной медицине Ступникова А.С., Захарова И.С., Шевченко А.И., Закиян С.М. VI Международная конференция молодых ученых: биофизиков, биотехнологов, молекулярных биологов и вирусологов Open Bio, |
|
| Разработка клеточных технологий для регенерации сосудов Захарова И.С., Живень М.К, Ступникова А.С., Шевченко А.И., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| Разработка подходов к применению митотически инактивированных васкулярных клеток в регенеративной медицине Ступникова А.С., Захарова И.С., Шевченко А.И., Закиян С.М. IV Национальный конгресс по регенеративной медицине |
|
| 2018 | Fungi Metarhizium spp. from Russia and neighboring territories: ecological preferences and activity against Colorado potato beetle larvae Olga Yaroslavtseva, Vadim Kryukov, Oksana Tomilova, Maksim Tyurin, Evgeniy Elisaphenko, Yuriy Tokarev, Viktor Glupov 51st ANNUAL MEETING of the SOCIETY FOR INVERTEBRATE PATHOLOGY and INTERNAT IONAL CONGRESS ON INVERTEBRATE PATHOLOGY AND MICROBIAL CONTROL |
| Получение кардиомиоцитов из пациент-специфичных индуцированных плюрипотентных стволовых клеток для моделирования наследственных сердечно-сосудистых заболеваний Дементьева Е.В., Медведев С.П., Коваленко В.Р., Югова К.А., Вяткин Ю.В., Кретов Е.И., Слотвицкий М.М., Штокало Д.Н., Покушалов Е.А., Закиян С.М. Всероссийская научно-практическая конференция «Новые вызовы и новые решения в кардиологии» |
|
| Моделирование наследственных аритмических заболеваний человека с использованием пациент-специфичных индуцированных плюрипотентных стволовых клеток Дементьева Е.В., Медведев С.П., Коваленко В.Р., Югова К.А., Вяткин Ю.В., Кретов Е.И., Слотвицкий М.М., Штокало Д.Н., Покушалов Е.А., Закиян С.М. Национальный медицинский инновационный форум |
|
| Исследование влияния мутаций в генах, ассоциированных с наследственной гипертрофической кардиомиопатией, с помощью пациент-специфичных индуцированных плюрипотентных стволовых клеток Дементьева Е.В., Медведев С.П., Коваленко В.Р., Вяткин Ю.В., Кретов Е.И., Слотвицкий М.М., Штокало Д.Н., Покушалов Е.А., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Модуляция кардиальной дифференцировки ИПСК человека с помощью Cas9-SAM активации гена SHOX2, отвечающего за пейсмейкерный путь развития кардиомиоцитов Павлова С.В., Медведев С.П., Дементьева Е.В., Чепелева Е.В., Сорокоумов Е.Д., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Evolutionary dynamics of the centromeric histone CENH3 within the tribe Triticeae. Evtushenko EV, Elisafenko EA, Gatzkaya SS, Lipikhina YA, Shubert V, Houben A, Vershinin AV. The fourth international scientific conference Chromosome 2018 |
|
| Ultrastructural defects in isogenic lines
of human cells with expanded CAG repeats
in the huntingtin gene obtained via the CRISPR/
Cas9 technology K.N. Morozova, L.A. Suldina, T.B. Malankhanova, E.V. Grigor’eva, S.M. Zakian, E. Kiseleva, A.A. Malakhova Crispr-2018 |
|
| Редактирование однонуклеотидной замены с.840 C>T в 7 экзоне гена SMN2 как потенциальный способ коррекции спинальной мышечной атрофии Валетдинова К.Р., Овечкина В.С., Закиян С.М. Первая международная научно-практическая конференция «Геномное редактирование в медицинской генетике 2018» в рамках III Всероссийского конгресса с международным участием «Орфанные болезни» |
|
| Редактирование однонуклеотидной замены с.840 C>T в 7 экзоне гена SMN2 как потенциальный способ коррекции спинальной мышечной атрофии Валетдинова К.Р., Овечкина В.С., Закиян С.М. Crispr-2018 |
|
| Получение астроцитов из линий индуцированных плюрипотентных стволовых клеток, несущих репортёрную конструкцию GFAP-RFP Григорьева Е.В., Сурумбаева А., Маланханова Т.Б., Павлова С.В., Медведев С.П., Малахова А.А., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Репрессия и активация гена Xist посредством системы CRISPR/Cas9 Шевченко А.И., Захарова И.С., Рифель Н.А., Григорьева Е.В., Медведев С.П., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Моделирование болезни Гентингтона на основе изогенных линий ИПСК с использованием CRISPR/Cas9 Маланханова Т.Б., Сурумбаева А.К., Григорьева Е.В., Малахова А.А., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Создание клеточных моделей, несущих мутации в гене НТТ, для изучения болезни Гентингтона Григорьева Е.В., Сурумбаева А., Маланханова Т.Б., Киселёва Е.В., Малахова А.А., Закиян С.М. Международный конгресс “CRISPR-2018” |
|
| Применение технологий геномного редактирования для моделирования и изучения механизмов развития болезни Гентингтона А.А. Малахова, Т.Б. Маланханова, Е.В. Григорьева, Л.А. Сульдина, К.Н. Морозова, Е.В. Киселева, С.М. Закиян. Первая международная научно-практическая конференция «Геномное редактирование в медицинской генетике» в рамках Третьего всероссийского научно-практического конгресса с международным участием «ОРФАННЫЕ БОЛЕЗНИ» |
|
| CRISPR/Cas9 опосредованное получение генетически модифицированной линии плюрипотентных стволовых клеток человека, экспрессирующих HIF — фактор, индуцируемый гипоксией Живень М.К., Захарова И.С., Смирнова А.М., Шевченко А.И., Орищенко К.Е., Елисафенко Е.А., Закиян С.М. Международный конгресс «CRISPR 2018» |
|
| Модуляция HIF (фактора, индуцируемого гипоксией) как перспективный подход к повышению регенеративного потенциала эндотелиальных клеток Захарова И.С., Живень М.К., Смирнова А.М., Шевченко А.И., Орищенко К.Е., Елисафенко Е.А., Закиян С.М. V Международная конференция «Постгеном’2018» |
|
| Делеция участка х-хромосомы, содержащего кластер микрорнк, нарушает процесс репрограммирования соматических клеток крысы к плюрипотентному состоянию Давлетшина Г.И., Шерстюк В.В., Закиян С.М. STEMCELLBIO-2018 |
|
| 2017 | ОПТИМИЗАЦИЯ ИНСТРУМЕНТОВ ГЕНОМНОГО РЕДАКТИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ КЛЕТОЧНЫХ МОДЕЛЕЙ БОЛЕЗНИ ХАНТИНГТОНА Маланханова Туяна Баировна, Малахова Анастасия Александровна, Закиян Сурен Минасович III Национальный Конгресс по Регенеративной Медицине |
| Получение генетически-модифицированной линии плюрипотентных стволовых клеток человека, экспрессирующей HIF-фактор, индуцируемый гипоксией Захарова И.С., Смирнова А.М.,Живень М.К., Шевченко А.И., Григорьева Е.В., Елисафенко Е.А., Закиян С.М. III Национальный Конгресс по Регенеративной Медицине |
|
| Использование системы CRISPR/Cas9 для изучения клеточной модели спинальной мышечной атрофии Валетдинова К.Р., Овечкина В.С., Григорьева Е.В., Маретина М.А., Киселев А.В., Баранов В.С., Медведев С.П., Закиян С.М. III Национальный Конгресс по Регенеративной Медицине |
|
| Создание клеточной платформы для изучения молекулярно-генетических механизмов патогенеза болезни Паркинсона. III Национальный конгресс по регенеративной медицине Коваленко В.Р., Вяткин Ю.В., Медведев С.П. III Национальный Конгресс по Регенеративной Медицине |
|
| Мониторинг трансплантации кардиальных мезенхимальных клеток крысы в периинфарктную зону миокарда с использованием люциферазной репортерной системы Павлова С.В., Милевская Е.А., Дементьева Е.В., Чепелева Е.В., Сергеевичев Д.С., Закиян С.М. III Национальный Конгресс по Регенеративной Медицине |
|
| Создание протокола направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека в средние шипиковые нейроны с возможностью продолжительного культивирования и трансгенеза предшественников данных клеток Е.В. Григорьева, Т.Б. Маланханова, А. Сурумбаева, С.В. Павлова, А.А. Малахова, С.М. Закиян III Национальный Конгресс по Регенеративной Медицине |
|
| Моделирование наследственных сердечно-сосудистых заболеваний с помощью индуцированных плюрипотентных стволовых клеток: успехи, проблемы и перспективы Дементьева Е.В., Медведев С.П., Елисафенко Е.А., Вяткин Ю.В., Штокало Д.Н., Байрамова С.А., Кретов Е.И., Покушалов Е.А., Караськов А.М., Закиян С.М. III Национальный Конгресс по Регенеративной Медицине |
|
| CRISPR/Cas9 in Huntington’s disease modeling Маланханова Т.Б., Малахова А.А., Павлова С.В., Медведев С.П., Закиян С.М. CRISPR: From Biology to Technology and Novel Therapeutics |
|
| CRISPR/Cas9 for targeted genome editing of paralogous genes in Brattleboro rats A.A. Nemudryi, T.B. Malankhanova, S.P. Medvedev, S.M. Zakian Cell Symposia. CRISPR: From Biology to Technology and Novel Therapeutics |
|
| Предшественники средних шипиковых нейронов, полученные из индуцированных плюрипотентных стволовых клеток человека, являются ещё одним инструментом для изучения патологии болезни Хантингтона Е.В. Григорьева, А. Сурумбаева, Т.Б. Маланханова, С.В. Павлова, К.Н. Морозова, А.А. Малахова, С.М. Закиян IV Национальный конгресс по болезни Паркинсона и расстройствам движений (с международным участием) |
|
| Создание клеточной платформы для исследования молекулярно-генетических механизмов патогенеза болезни Паркинсона Коваленко В.Р., Вяткин Ю.В., Медведев С.П., Закиян С.М. IV Национальный конгресс по болезни Паркинсона и расстройствам движений (с международным участием) |
|
| Современные подходы, используемые для изучения болезней двигательного нейрона Валетдинова К.Р., Устьянцева Е.И., Григорьева Е.В., Маретина М.А., Куранова М.Л., Киселев А.В., Баранов В.С., Сорокоумов Е.Д.,Ратушняк А.С., Кизилова Е.А., Минина Ю.М., Ветчинова А.С., Иллариошкин С.Н., Медведев С.П., Закиян С.М. IV Национальный конгресс по болезни Паркинсона и расстройствам движений (с международным участием) |
|
| Дифференцировка индуцированных плюрипотентных стволовых клеток человека в нейроны стриатума для создания модели in vitro болезни Хантингтона Е.В. Григорьева, А. Сурумбаева, Т.Б. Маланханова, С.В. Павлова, Л.А. Сульдина, С.М. Закиян БЕЛЯЕВСКИЕ ЧТЕНИЯ, Международная конференция, посвященная 100-летию со дня рождения академика АН СССР Д.К. Беляева |
|
| Xist gene and chromatin modifications during imprinted X chromosome inactivation in vole M. levis A.I. Shevchenko, E.V. Grigor’eva, I.S. Zakharova, S.M. Zakian БЕЛЯЕВСКИЕ ЧТЕНИЯ, Международная конференция, посвященная 100-летию со дня рождения академика АН СССР Д.К. Беляева |
|
| Электронно-микроскопический анализ ультраструктурной реорганизации клеток с делециями и встройками в ген хантингтина К.Н. Морозова, Л.А. Сульдина, Т.Б. Маланханова, А.А. Малахова, С.И. Закиян, Е.В. Киселева Международная конференция «Беляевские чтения», посвященная 100-летию академика АН СССР Д.К. Беляева |
|
| Analysis of microRNA expression in rat pluripotent stem cells using genome-wide sequencing technologies Sherstyuk V.V., Medvedev S.P., Elisaphenko E.A., Vaskova E.A., Ri M.T., Vyatkin Y.V., Saik O.V., Shtokalo D.N., Pokushalov E.A., Zakian S.M. 15th Annual Meeting of the International Society for Stem Cell Research |
|
| The studying of activation effects of HIF transcription factor in human pluripotent stem cells on the potential of endothelial angiogenic derivatives Smirnova A., Zakharova I., Jiven M., Shevchenko A., Zakian S. IX international congress «Biotechnology: state of the art and perspectives». |
|
| The study of activation effects of HIF transcription factor on the potential of endothelial angiogenic derivatives in human pluripotent stem cells Smirnova A., Zakharova I., Zhiven M., Shevchenko A., Elisaphenko E., Zakian S. 25th Wilhelm Bernhard Workshop on the Cell Nucleus. |
|
| Исследование эффектов активации фактора, индуцируемого гипоксией, на ангиогенный потенциал эндотелиальных производных плюрипотентных стволовых клеток человека Смирнова А.М., Живень М.К., Захарова И.С., Шевченко А.И., Елисафенко Е.А., Закиян С.М. Беляевские чтения : Международная конференция, посвященная 100-летию со дня рождения академика AН СССР Д.К. Беляева |
|
| Сравнительный анализ экспериментальных опухолей, происходящих из ЭСК и ИПСК человека (по результатам тератомного теста) Кизилова Е.А., Валетдинова К.Р., Захарова И.С. III Национальный Конгресс по Регенеративной Медицине |
|
| Экспрессия генов OXA1l и BCS1l, определяющих метаболизм АТФ, задействованных в патогенезе варикозной болезни вен, клетками венозной стенки Сметанина М.А., Захарова И.С., Севостьянова К.С., Филиппенко М.Л. III Национальный Конгресс по Регенеративной Медицине |
|
| Направленное внесение делеций в геном фибробластов крысы для изучения функций микроРНК в процессе перепрограммирования к плюрипотентному состоянию Давлетшина Г.И., Шерстюк В.В., Закиян С.М. III Национальный Конгресс по Регенеративной Медицине |
|
| 2016 | Получение модельной системы спинальной мышечной атрофии на основе индуцированных плюрипотентных стволовых клеток человека Валетдинова К.Р., Григорьева Е.В., Закиян С.М. Биомедицина-2016 |
| Использование индуцированных плюрипотентных стволовых клеток в моделировании нейродегенеративных заболеваний Григорьева Е.В. Биомедицина-2016 |
|
| Generation of isogenic cell model to study mechanisms of Huntington’s disease in vitro Anastasia A. Malakhova, Michael A. Sorokin, Anastasia E. Sorokina, Tuyana B. Malankhanova, Sergey P. Medvedev, Suren M. Zakian Neuroscience 2016 |
|
| СОЗДАНИЕ КЛЕТОЧНОЙ МОДЕЛИ БОЛЕЗНИ ХАНТИНГТОНА С ИСПОЛЬЗОВАНИЕМ МЕТОДОВ РЕДАКТИРОВАНИЯ ГЕНОМА Малахова А.А., Маланханова Т.Б., Сорокин М.А., Сорокина А.Е., Закиян С.М. Биомедицина-2016 |
|
| Generation of isogenic cell model of Huntington's disease using genome editing approach Anastasia A. Malakhova, Michael A. Sorokin, Tuyana B. Malankhanova, Anastasia E. Sorokina, Sergey P. Medvedev, Suren M. Zakian International Conference Cell Technologies at The Edge: Research & Practice |
|
| ИНДУЦИРОВАННЫЕ ПЛЮРИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ МОДЕЛЬНЫХ ЖИВОТНЫХ КАК ОБЪЕКТЫ БИОМЕДИЦИНСКИХ ИССЛЕДОВАНИЙ Васькова Е.А. Биомедицина-2016 |
|
| РЕДАКТИРОВАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА AVP КРЫС ЛИНИИ BRATTLEBORO С ПОМОЩЬЮ СИСТЕМЫ CRISPR/CAS Немудрый А.А., Маланханова Т.Б., Васькова Е.А., Медведев С.П., Закиян С.М. Биомедицина-2016 |
|
| CRISPR-революция в биологии и медицине Медведев С.П. Биомедицина-2016 |
|
| Modeling long QT syndrome using patient-specific induced pluripotent stem cells Dementyeva E.V., Grigor’eva E.V., Vyalkova A.V., Medvedev S.P., Shevchenko A.I., Elisaphenko E.A., Bairamova S.A., Pokushalov E.A., Karaskov A.M., Zakian S.M. Cell technologies at the edge: research & practice |
|
| Применение индуцированных плюрипотентных стволовых клеток человека для моделирования сердечно-сосудистых заболеваний Дементьева Е.В. форум "Биомедицина-2016" |
|
| Возможности создания биологического водителя ритма сердца Якубов А.А., Лосик Д.В., Медведев С.П., Байрамова С.А., Стрельников А.Г., Романов А.Б., Дементьева Е.В., Покушалов Е.А. форум "Биомедицина-2016" |
|
| The molecular mechanisms of the heterochromatin expansion in the rye chromosomes Evtushenko EV, Levitsky VG, Elisafenko EA, Gunbin KV, Belousov AI, Safar J, Dolezel J, Vershinin AV 21st International Chromosome Conference (ICC) |
|
| Generation of iPSC-based model of Huntington's disease using CRISPR/Cas9 technique Malankhanova B.T. (Tuyana), Malakhova A.A. (Anastasia) International student congress of (bio)medical sciences |
|
| Создание панели изогенных линий клеток, моделирующих болезнь Хантингтона in vitro Шарипова Д.В., Маланханова Т.Б. Международная научная студенческая конференция, НГУ, Новосибирск |
|
| Мониторинг трансплантации кардиальных стромальных клеток крысы в зону ишемического поражения миокарда с использованием люциферазной репортерной системы. Милевская Е. А., Чепелева Е. В., Павлова С. В. Форум «Биомедицина-2016» |
|
| Регенерация миокарда: источник кардиомиоцитов в постнатальном сердце Павлова С.В. форум "Биомедицина-2016" |
|
| Development of tissue-engineering cell-seeded chitosan-polycaprolactone blends for vascular surgery Smirnova A., Zakharova I.S. The tenth international conference on bioinformatics of genome regulation and structure/systems biology |
|
| Development of tissue-engineered chitosan-polycaprolactone blends for vascular surgery Smirnova A., Zakharova I.S., Zhiven’ M.K., Saaya S.B., Strunov A.A., Zakian S.M. 12nd International Congress of cell biology |
|
| Изменение организации эмбриональных стволовых клеток человека под действием гипоксии, индуцированной СoСl2 Сульдина Л.А., Захарова И.С., Стригина (Идимишева) Е.В., Шевченко А.И., Киселева Е.В. Форум «Биомедицина-2016» |
|
| Разработка клеточных технологий для создания клеточно-наполненных сосудистых трансплантатов Захарова И.С., Саая Ш.Б., Живень М.К., Шевченко А.И., Струнов А.А., Смирнова А.М., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Закиян С.М. Форум «Биомедицина-2016». |
|
| Эпигенетический статус х-хромосом в плюрипотентных стволовых клетках человека Стригина (Идимишева) Е.В., Шевченко А. И., Захарова И.С., Закиян С.М. Всероссийской конференция с международным участием «StemCellBio-2016: фундаментальная наука как основа клеточных технологий» |
|
| Neural differentiation of induced pluripotent stem cells derived from patients with spinal muscular atrophy type I E.V. Grigor’eva, K.R. Valetdinova, Е.I. Ustyantseva,S.M. Zakian Neuroscience 2016 |
|
| 2015 | Получение модельных систем болезней моторных нейронов на основе плюрипотентных клеток человека Валетдинова К.Р., Устьянцева Е.И., Медведев С.П., Закиян С.М. II Национальный конгресс по регенеративной медицине |
| Условия, необходимые для получения индуцированных плюрипотентных стволовых клеток обыкновенных полёвок рода Microtus Григорьева Е.В., Шевченко А.И. Международная конференция «Хромосома-2015» |
|
| СРАВНИТЕЛЬНЫЙ АНАЛИЗ ТРАНСКРИПТОМА СОМАТИЧЕСКИХ И ПЛЮРИПОТЕНТНЫХ КЛЕТОК КРЫСЫ Васькова Е.А., Шерстюк В.В., Медведев С.П., Гопаненко А.В., Малыгин А.А., Кабилов М.Р., Карпова Г.Г., Закиян С.М. Хромосома 2015 |
|
| Ориджины репликации Х-хромосомы центра инактивации Х-хромосомы полевки Microtus levis Шерстюк В.В., Шевченко А.И., Закиян С.М. Международная конференция «Хромосома-2015» |
|
| Использование пациент-специфичных индуцированных плюрипотентных стволовых клеток для моделирования синдрома удлиненного интервала QT Дементьева Е.В., Григорьева Е.В., Вялкова А.В., Медведев С.П., Шевченко А.И., Елисафенко Е.А., Байрамова С.А., Иванисенко Н.В., Иванисенко В.А., Покушалов Е.А., Караськов А.М., Закиян С.М. VI Всероссийский съезд аритмологов |
|
| Новые методы геномной инженерии в биомедицинских исследованиях. Медведев С.П., Закиян С.М. VII Съезд Российского общества медицинских генетиков |
|
| Модельные системы болезней моторных нейронов на основе плюрипотентных клеток человека Валетдинова К.Р., Медведев С.П., Закиян С.М. СИМБИОЗ – РОССИЯ 2015 (VIII Всероссийский с международным участием Конгресс молодых ученых-биологов) |
|
| Создание и характеристика инструментов, предназначенных для внесения мутаций в ген SOD1, на основе систем TALENs и CRISPR/Cas9 Устьянцева Е.И., Валетдинова К.Р., Медведев С.П. Биология - наука 21 века |
|
| Создание клеточной модели для изучения синдрома удлиненного интервала QT Дементьева Е.В., Вялкова А.В., Григорьева Е.В., Медведев С.П., Шевченко А.И., Елисафенко Е.А., Байрамова С.А., Покушалов Е.А., Караськов А.М., Закиян С.М. 2-ой Национальный конгресс по регенеративной медицине |
|
| Создание системы для исправления мутации в культивируемых клетках крыс линии Brattleboro Маланханова Т.Б., Немудрый А.А., Васькова Е.А., Медведев С.П. 19-я Международная Пущинская школа-конференция молодых ученых "Биология - наука XXI века" |
|
| Сравнение региональных стволовых клеток сердца, кожи и костного мозга человека Павлова С.В., Сергеевичев Д.С., Малахова А.А., Захарова И.С., Григорьева Е.В., Покушалов Е.А., Закиян С.М. II Национальный конгресс по регенеративной медицине |
|
| СОЗДАНИЕ СОСУДИСТЫХ ТРАНСПЛАНТАТОВ С КЛЕТОЧНЫМ ЗАСЕЛЕНИЕМ Саая Ш.Б., Захарова И.С., Живень М.К., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Шевченко А.И., Закиян С.М. XXX Международная конференция Российского общества ангиологов и сосудистых хирургов |
|
| Получение функциональных эндотелиальных и гладкомышечных клеток из материала кардиальных эксплантов человека Захарова И.С., Шевченко А.И., Живень М.К., Саая Ш.Б., Струнов А.А., Смирнова А.М., Карпенко А.А., Покушалов Е.А., Закиян С.М., Иванова Л.Н. II Национальный конгресс по регенеративной медицине |
|
| Возможности использования индуцированных плюрипотентных стволовых клеток с исправленным генотипом в области заместительной клеточной терапии на модели крыс Brattleboro Васькова Е.А., Медведев С.П., Шерстюк В.В., Немудрый А.А., Сорокина А.Е., Елисафенко Е.А., Иванова Л.Н., Закиян С.М. II Национальный конгресс по регенеративной медицине |
|
| Сравнение региональных стволовых клеток сердца, кожи и костного мозга человека Павлова С.В., Сергеевичев Д.С., Малахова А.А., Захарова И.С., Григорьева Е.В., Покушалов Е.А. Закиян С.М. II Национальный конгресс по регенеративной медицине 2015 г. 3–5 декабря, Москва, ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России |
|
| 2014 | Разработка подхода к получению клеточно-наполненного сосудистого трансплантата Захарова И.С., Шевченко А.И., Живень М.К., Саая Ш.Б., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Караськов А.М., Сухих Г.Т., Закиян С.М. Международная конференция по биопринтингу и биофабрикации |
| ПОДХОДЫ К ПОЛУЧЕНИЮ ВАСКУЛЯРНЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ В ТКАНЕВОЙ ИНЖЕНЕРИИ СОСУДОВ Захарова И.С., Шевченко А.И., Живень М.К., Саая Ш.Б., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Караськов А.М., Сухих Г.Т., Закиян С.М. симпозиум "Новейшие методы клеточных технологий в медицине" |
|
| Клеточные технологии в регенеративной медицине и моделировании заболеваний человека. Медведев С.П. Международная молодежная научная конференция "Современные проблемы генетики, клеточной биологии и биотехнологии" |
|
| Применение современных систем редактирования генома для получения клеточной модели бокового амиотрофического склероза на основе изогенных линий эмбриональных стволовых клеток человека, несущих мутации в гене SOD1 Валетдинова К.Р., Устьянцева Е.И., Медведев С.П., Васькова Е.А., Закиян С.М. Современные проблемы генетики, клеточной биологии и биотехнологии |
|
| Конструкция межвидовых «мышь---крыса» химерных бластоцист для in vivo оценки плюрипотентности стволовых клеток крысы Казак* Е.А., Васькова Е.А., Кизилова Е.А., Байбородин С.И., Голубица А.Н., Железова А.И. VII Школа-Конференция «Актуальные проблемы биологии развития» |
|
| Creating a family-based model system for studying long QT syndrome Dementyeva E., Grigor’eva E., Vyalkova A., Medvedev S., Shevchenko A., Elisaphenko E., Bairamova S., Pokushalov E., Ivanova L., Zakian S. 12th Annual Meeting of the International Society for Stem Cell Research |
|
| Моделирование сердечно-сосудистых заболеваний с использованием индуцированных плюрипотентных стволовых клеток человека Дементьева Е.В., Григорьева Е.В., Вялкова А.В., Медведев С.П., Шевченко А.И., Елисафенко Е.А., Байрамова С.А., Покушалов Е.А., Иванисенко Н.В., Иванисенко В.А., Караськов А.М., Сухих Г.Т., Закиян С.М. Первый всероссийский симпозиум «Новейшие методы клеточных технологий в медицине» |
|
| Создание модели синдрома удлиненного интервала QT при помощи индуцированных плюрипотентных стволовых клеток человека Вялкова А.В., Григорьева Е.В., Дементьева Е.В., Медведев С.П., Шевченко А.И., Елисафенко Е.А., Байрамова С.А., Покушалов Е.А., Закиян С.М. Первый всероссийский симпозиум «Новейшие методы клеточных технологий в медицине» |
|
| Application of human induced pluripotent stem cells for modelling long QT syndrome Dementyeva E.V., Grigor’eva E.V., Vyalkova A.V., Medvedev S.P., Shevchenko A.I., Elisaphenko E.A., Bairamova S.A., Pokushalov E.A., Ivanisenko N.V., Ivanisenko V.A., Karaskov A.M., Sukhikh G.T., Zakian S.M. IV Международная научно-практическая конференция «Постгеномные методы анализа в биологии, лабораторной и клинической медицине» |
|
| Разработка методов терапии инфаркта миокарда у крыс линии WAG, основанных на трансплантации клеток кардиальной культуры Е. В. Чепелева, С. В.Павлова, А. А. Малахова, Е. А. Милевская, Я. Л. Русакова, Н. А. Подхватилина, Д. С. Сергеевичев, Е.А. Покушалов, А. М. Караськов, Г. Т. Сухих, С. М. Закиян Симпозиум “Новейшие методы клеточных технологий в медицине” |
|
| Отличия в ультраструктурной организации эмбриональных и индуцированных плюрипотентных стволовых клеток Сульдина Л.А., Павлова С.В., Малахова А.А., Стекленева А.Е., Васькова Е.А., Закиян С.М., Киселева Е.В. Симпозиум “Новейшие методы клеточных технологий в медицине” |
|
| Создание клеточной модели болезни Хантингтона с использованием технологии редактирования генома Малахова А.А., Сорокин М.А., Стекленёва А.Е., Закиян С.М. Международная молодежная научная конференция «Современные проблемы генетики, клеточной биологии и биотехнологии» |
|
| Исправление мутантного генотипа в клетках крыс линии Brattleboro с помощью современных методов геномной инженерии Немудрый А.А., Сорокина А.Е., Васькова Е.А., Медведев С.П., Иванова Л.Н., Закиян С.М. VI съезд Вавиловского общества генетиков и селекционеров (ВОГиС) и ассоциированные генетические симпозиумы |
|
| 2013 | Контроль транскрипционного статуса генов Х-хромосомы человека в клеточной терапии с использованием линий плюрипотентных стволовых клеток и их дифференцированных производных Шевченко А.И., Захарова И.С., Сметанина М.А., Закиян С.М. 1 национальный конгресс по регенеративной медицине |
| РАЗРАБОТКА МЕТОДА ПОЛУЧЕНИЯ КЛЕТОЧНО-НАПОЛНЕННОГО СОСУДИСТОГО ТРАНСПЛАНТАТА С ИСПОЛЬЗОВАНИЕМ НАПРАВЛЕННОЙ ВАСКУЛЯРНОЙ ДИФФЕРЕНЦИРОВКИ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА Захарова И.С., Шевченко А.И., Живень М.К., Саая Ш.Б., Карпенко А.А., Покушалов Е.А., Иванова Л.Н., Сухих Г.Т., Закиян С.М. 1 национальный конгресс по регенеративной медицине |
|
| Регенеративный потенциал кардиальных клеток из экспланта сердечной мышцы человека Чепелева Е.В., Павлова С.В., Малахова А.А., Перовский П.П., Дементьева Е.В., Покушалов Е.А., Закиян С.М. 1 национальный конгресс по регенеративной медицине |
|
| Исследование транскриптомов плюрипотентных клеток крысы с помощью метода RNA-seq Стекленева А.Е. Васькова Е.А. Немудрый А.А. Евшин И.С. Шарипов Р.Н. Колпаков Ф.А. Медведев С.П. XX МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ СТУДЕНТОВ, АСПИРАНТОВ И МОЛОДЫХ УЧЕНЫХ "ЛОМОНОСОВ" |
|
| Направленная васкулярная дифференцировка стволовых клеток человека и их применение в разработке клеточно-наполненных сосудистых трансплантатов Захарова И.С., Шевченко А.И., Закиян С.М. Пятая Международная Школа молодых ученых «Системная биология и биоинформатика» («System Biology and Bioinformatics, SBB’2013) |
|
| Характеристика синдрома удлиненного интервала QT при помощи пациент-специфичных индуцированных плюрипотентных стволовых клеток Вялкова А.В., Григорьева Е.В., Дементьева Е.В. XIX Международная научная конференция студентов, аспирантов и молодых ученых «Ломоносов-2013» |
|
| Studying long QT syndrome using patient-specific induced pluripotent stem cells Dementyeva E.V., Grigor’eva E.V., Vyalkova A.V., Medvedev S.P., Shevchenko A.I., Zakian S.M. The 5th International Young Scientists School “Systems Biology & Bioinformatics” |
|
| INTENSIVE RECOMBINATIONS HAVE LED TO TANDEM REPEAT EXPANSION AND ENLARGEMENT OF RYE SUBTELOMERIC HETEROCHROMATIN VERSHININ A.V., EVTUSHENKO E.V., ELISAFENKO A.E., GUNBIN K., LEVITSKY V.G. The 19th International Chromosome Conference |
|
| Создание модели синдрома удлиненного интервала QT с использованием семейного подхода Дементьева Е.В., Григорьева Е.В., Вялкова А.В., Медведев С.П., Шевченко А.И., Елисафенко Е.А., Байрамова С.А., Покушалов Е.А., Караськов А.М., Сухих Г.Т., Закиян С.М. 1-ый Национальный конгресс по регенеративной медицине |
|
| Паттерн транскрипции белок-кодирующих и регуляторных РНК в плюрипотентных клетках крысы Стекленева А.Е., Медведев С.П., Васькова Е.А., Немудрый А.А., Елисафенко Е.А., Евшин И.С., Шарипов Р.Н., Сайфутдинова С.Г., Кизилова Е.А., Железова А.И., Иванова Л.Н., Покушалов Е.А., Закиян С.М. V ВСЕРОССИЙСКАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «СТВОЛОВЫЕ КЛЕТКИ И РЕГЕНЕРАТИВНАЯ МЕДИЦИНА» |
|
| In vivo оценка плюрипотентности ЭСК и ИПСК крысы на модели первичного межвидового химеризма "мышь---крыса" Васькова Е.А., Кизилова* Е.А., Голубица А.Н., Железова А.И. VII Школа-Конференция «Актуальные проблемы биологии развития |
|
| 2012 | ИССЛЕДОВАНИЕ ЭПИГЕНЕТИЧЕСКОГО СТАТУСА Х-ХРОМОСОМЫ В ЛИНИЯХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА Захарова Ирина Сергеевна, Шевченко Александр Игоревич, Григорьева Елена Викторовна, Малахова Анастасия Александрона, Сметанина Мария Александровна, Закиян Сурен Минасович ХРОСОМОМА 2012 |
| Получение и характеристика плюрипотентных стволовых клеток крыс линий Brattleboro и WAG Немудрый А.А., Стекленева А.Е., Васькова Е.А. мнск 2012 г. новосибирск |
|
| Получение модели наследственного гипоталамического несахарного диабета на основе плюрипотентных стволовых клеток крыс линии Brattleboro Немудрый А.А., Стекленева А.Е., Васькова Е.А. Ломоносов-2012 |
|
| Создание плазмидных и аденовирусных векторов, предназначенных для получения индуцированных плюрипотентных стволовых клеток человека Ковлягина И.С., Дементьева Е.В. 50-я юбилейная Международная научная студенческая конференция «Студент и научно-технический прогресс» |
|
| Модификации неактивного хроматина при различных формах сайленсинга Х-хромосомы у грызунов Шевченко А.И., Дементьева Е.В., Павлова С.В., Григорьева Е.В., Закиян С.М. Хромосома 2012, Новосибирск, 2-7 сентября |
|
| Сравнительная характеристика эмбриональных стволовых и индуцированных плюрипотентных стволовых клеток крысы Стекленева А.Е., Васькова Е.А., Немудрый А.А., Минина Ю. М., Медведев С. П. Ломоносов 2012: XIX Международная конференция студентов, аспирантов и молодых ученых |
|
| Создание плазмидных и аденовирусных векторов, предназначенных для получения индуцированных плюрипотентных стволовых клеток человека Ковлягина И.С., Дементьева Е.В. XIX Международная научная конференция студентов, аспирантов и молодых ученых «Ломоносов-2012» |
|
| 2011 | Индуцированные плюрипотентные стволовые клетки - модели для изучения патогенеза заболеваний и источник материала для заместительной клеточной терапии Медведев С.П. IX научная конференция "Генетика человека и патология: актуальные проблемы современной цитогенетики" |
| Paternal X-chromosome is preinactivated at early stages of imprinted X-inactivation in rodents Dementyeva E.V., Vaskova E.A., Shevchenko A.I., Pavlova S.V., Zakian S.M. EMBO Workshop "50 YEARS OF X INACTIVATION RESEARCH" (3rd X-inactivation Conference), July 20-24, 2011, Oxford, UK |
|
| Epigenetic status of X chromosome in female human induced pluripotent stem cells Evgeniya A. Vaskova, Alexander I. Shevchenko, Ekaterina A. Gracheva, Sergey P. Medvedev, Elena V. Grigor'eva, Anastasiya A. Malakhova, Suren M.Zakian EMBO Workshop "50 YEARS OF X INACTIVATION RESEARCH" (3rd X-inactivation Conference), July 20-24, 2011, Oxford, UK |
|
| Картирование сайтов инициации репликации в центре инактивации X-хромосомы полевки Microtus rossiameridionalis Шерстюк Владимир Владимирович Международная научная студенческая конференция "Студент и научно-технический прогресс" (26-30 апреля, г. Новосибирск) |
|
| Картирование сайтов инициации репликации в центре инактивации X-хромосомы полевки Microtus rossiameridionalis Шерстюк Владимир Владимирович Международная научная конференция студентов, аспирантов и молодых учёных "Ломоносов-2011" Москва. |
|
| Репрограммирование нейральных стволовых клеток крысы к плюрипотентному состоянию Стекленева Анастасия Евгеньевна XIII МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ СТУДЕНТОВ, АСПИРАНТОВ И МОЛОДЫХ УЧЕНЫХ "ЛОМОНОСОВ" |
|
| 2010 | Получение индуцированных плюрипотентных стволовых клеток из фетальных нейральных стволовых клеток человека Медведев С.П., Григорьева Е.В., Шевченко А.И., Малахова А.А., Дементьева Е.В., Соболев И.А., Александрова М.А., Плотников Е.Ю., Сухих Г.Т., Закиян С.М. IV Всероссийский симпозиум с международным участием "Актуальные вопросы тканевой и клеточной трансплантологии" (Санкт-Петербург, 21-22 апреля 2010 г.) |
| Дозовая компенсация генов половых хромосом у эукариот Дементьева Е.В. V Международная конференция по кариосистематике беспозвоночных животных (KARYO V) с 16 по 20 августа 2010 г. г. Новосибирск |
|
| От изоферментов до эмбриональных стволовых клеток Закиян С.М. Конференция "Генетика развития и нейрогенетика", Москва, 25-27 мая 2010 г. |
|
| Структура хроматина неактивной Х-хромосомы у обыкновенных полевок Васькова Е.А., Шевченко А.И., Павлова С.В., Дементьева Е.В., Григорьева Е.В., Закиян С.М. XVI Всероссийский симпозиум "СТРУКТУРА И ФУНКЦИИ КЛЕТОЧНОГО ЯДРА" 5–7 октября 2010 г.С-Петербург |
|
| 2009 | Статусы экспрессии и метилирования генов Х-хромосомы в соматических и экстраэмбриональных тканях обыкновенных полевок Дементьева Е.В., Шевченко А.И., Вагнер Т.В., Закиян С.М. Международная конференция "Хромосома 2009", Новосибирск, 31 августа-6 сентября |
| Трофобластные стволовые клетки обыкновенной полевки рода Microtus – модель для изучения импринтированной инактивации Х-хромосомы Григорьева Е.В., Шевченко А.И., Закиян С.М. Международная конференция "Хромосома 2009", Новосибирск, 31 августа-6 сентября |
|
| Экспрессия генов раннего развития у обыкновенной полевки Microtus rossiaemeridionalis Сорокин М.А. Международная конференция студентов, аспирантов и молодых ученых "Ломоносов-2009", г. Москва |
|
| Изучение статуса экспрессии генов Х-хромосомы у обыкновенных полевок рода Microtus Вагнер Т.В., Дементьева Е.В. Международная конференция студентов, аспирантов и молодых ученых "Ломоносов-2009", г. Москва |
|
| Сходный паттерн распределения модификаций хроматина на неактивной Х-хромосоме в процессе мейотической и импринтированной инактивации у обыкновенных полевок Васькова Е.А. Международная конференция студентов, аспирантов и молодых ученых "Ломоносов-2009", г. Москва |
|
| Модификации хроматина неактивной Х-хромосомы у обыкновенных полевок Васькова Е.А., Шевченко А.И., Павлова С.В., Дементьева Е.В., Григорьева Е.В., Закиян С.М. Международная конференция "Хромосома 2009", Новосибирск, 31 августа-6 сентября |
|
| Трофобластные стволовые клетки полевок рода Microtus Григорьева ЕВ, Шевченко АИ, Мазурок НА, Закиян СМ Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Особенности организации и инактивации Х-хромосомы у сумчатых опоссумов Захарова И.С., Шевченко А.И., Елисафенко Е.А., Шилов А.Г., Закиян С.М. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Исследование транскрипционной регуляции и происхождения гена Tsix Жукова О.А., Елисафенко Е.А., Закиян С.М. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Молекулярная структура субтеломерного гетерохроматина ржи Евтушенко Е.В., Елисафенко Е.А., Вершинин А.В. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Некодирующие регуляторные РНК Х хромосомы млекопитающих. Происхождение и эволюция Колесников Н.Н., Елисафенко Е.А. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Структурно-функциональная организация регуляторных районов гена Xist полевки Microtus Rosiaemeridionalis Орищенко К.Е., Елисафенко Е.А. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| Модификации хроматина неактивной Х-хромосомы в процессе мейотической и импринтированной инактивации у обыкновенных полевок Васькова Е.А. XLVII Международная научная студенческая конференция "Студент и научно-технический прогресс" (МНСК-47) г.Новосибирск, 11 – 15 апреля 2009 г. |
|
| Получение плюрипоентных линий гибридных клеток для изучения процесса инактивации Х-хромосомы обыкновенных полевок рода Microtus Малахова А.А., Григорьева Е.В., Шевченко А.И. Ломоносов-2009: Международная конференция студентов, аспирантов и молодых ученых; секция «Биология» |
|
| Экспрессия последовательностей района центра инактивации Х-хромосомы полевок рода Microtus Малахова А.А., Шевченко А.И., Елисафенко Е.А., Закиян С.М. «Хромосома 2009» |
|
| Характеристика трофобластных стволовых клеток полевок рода Microtus. Григорьева Е.В., Шевченко А.И., Мазурок Н.А., Закиян С.М. Пятый Съезд Вавиловского общества генетиков и селекционеров Москва, 21-28 июня 2009 |
|
| Получение индуцированных плюрипотентных стволовых клеток человека С.П. Медведев, Е.В. Григорьева, А.А. Малахова, А.И. Шевченко, Д.А. Савушкина, В.В. Бернвальд, И.А. Соболев, С.М. Закиян. Материалы Всероссийской научной школы-конференции для молодежи «Аутологичные стволовые клетки: экспериментальные и клинические исследования» |
|
| 2008 | X-chromosome inactivation, mobile elements and ncRNA genes Kolesnikov N.N., Elisafenko E.A. 6th international conference on bioinformatics of genome regulation and structure BGRS’2008, Novosibirsk, June 22-28 |
| Модификации хроматина и статус экспрессии генов при импринтированной и случайной инактивации X-хромосомы у млекопитающих Шевченко АИ, Закиян С.М. IV съезд Российского Общества биохимиков и молекулярных биологов, 10-15 мая, Новосибирск, 2008 |
|
| Вклад мобильных элементов генома в образование и эволюцию нкРНК гена Xist млекопитающих Колесников Н.Н., Елисафенко Е.А., Шевченко А.И, Закиян С.М. (4) IV съезд Российского Общества биохимиков и молекулярных биологов, 10-15 мая, Новосибирск, 2008 |
|
| Специализированные районы хромосом: гетерогенные ДНК, консервативные функции Вершинин А.В., Евтушенко Е.В. IV съезд Российского Общества биохимиков и молекулярных биологов, 10-15 мая, Новосибирск, 2008 |
|
| Сравнение модификаций хроматина неактивной Х-хромосомы фибробластов и трофобластных стволовых клеток обыкновенных полевок Васькова Е.А., Дементьева Е.В Международная научная студенческая конференция "Студент и научно-технический прогресс" (26-30 апреля, г. Новосибирск) |
|
| Исследование регуляторной области гена Tsix полевки Microtus rossiaemeridionalis Жукова О.А., Орищенко К.Е. Международная студенческая конференция "Студент и научно-технический прогресс" |
|
| Закономерности и парадоксы эволюции теломерных районов хромосом Вершинин А.В. Симпозиум "Хромосомы и Эволюция" Памяти ГА Левитского, Санкт-Петербург, 26-27 ноября 2008 г |
|
| 2007 | Как происходит инактивация Х хромосомы у сумчатых млекопитающих Захарова И.С., Шевченко А.И., Елисафенко Е.А. Междунар. молодежная научно-методическая конф. "Проблемы молекулярной и клеточной биологии", посвященная 50-летию СО РАН, Томск 10-12 мая 2007 |
| Oct4 и Nanog – ключевые гены в системе поддержания плюрипотентности клеток млекопитающих Медведев С.П., Шевченко А.И., Елисафенко Е.А., Закиян С.М. Междунар. молодежная научно-методическая конф. "Проблемы молекулярной и клеточной биологии", посвященная 50-летию СО РАН, Томск 10-12 мая 2007 |
|
| Исследование регуляторной области гена Xist полевки Microtus rossiaemeridionalis Орищенко К.Е., Елисафенко Е.А. Междунар. молодежная научно-методическая конф. "Проблемы молекулярной и клеточной биологии", посвященная 50-летию СО РАН, Томск 10-12 мая 2007 |
|
| Эволюция и происхождение центра инактивации половых хромосом млекопитающих Колесников Н.Н., Елисафенко Е.А., Шевченко А.И. и Закиян С.М. Международная конференция "Развитие эволюционной идеи в биологии, социологии и медицине". Конференция посвящена 90-летию со дня рождения академика Д.К.Беляева 7 - 9 августа 2007 года |
|
| Идентификация гена Xist и исследование модификаций хроматина неактивной Х-хромосомы у самок Sorex araneus L. Сорокин М.А., Шевченко А.И., Елисафенко Е.А., Захарова И.С., Медведев С.П., Орищенко К.Е. Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Модификации хроматина неактивной Х-хромосомы у обыкновенных полевок рода Microtus Шевченко А.И., Павлова С.В., Дементьева Е.В. Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Получение и характеристика стволовых клеток экстраэмбриональной энтодермы полевок рода Microtus Демина ВВ, Шевченко АИ, Григорьева ЕВ, Шилов АГ, Павлова СВ Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Центр инактивации Х-хромосомы обыкновенных полевок: Характеристика последовательностей ДНК и анализ экспрессии генов А.А.Малахова, А.И.Шевченко Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Картирование и статус экспрессии генов Х-хромосомы у обыкновенных полевок Дементьева Е.В., Шевченко А.И., Аноприенко О.В., Мазурок Н.А., Закиян С.М. Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Получение трофобластных стволовых клеток обыкновенных полевок рода Microtus в отсутствие фактора Fgf2 Григорьева Е.В., Шевченко А.И., Мазурок Н.А. Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Теломеры и центромеры: консервативные функции, гетерогенные ДНК Вершинин А.В. Международная молодежная научно-методическая конференция "Проблемы молекулярной и клеточной биологии", г. Томск |
|
| Трофобластные стволовые клетки обыкновенных полевок как модель для изучения in vitro процессов имплантации и плацентации Е.В.Григорьева, А.И.Шевченко, П.А.Дыбан, А.П.Дыбан, Н.А.Мазурок, С.М.Закиян Симпозиум с международным участием "Клеточные, молекулярные и эволюционные аспекты морфогенеза", Москва |
|
| 2006 | B chromosomes of the grasshopper Podisma kanoi Storozh. (Orthoptera, Acridi-dae): distribution and DNA contents Rubtsov N., Karamysheva T., Perepelov E., Elisaphenko E., Warchaowska-liwa E., Tatsuta H., Bugrov A. 17th European Colloquium on Animal Cytogenetic and Gene Mapping, Lissbon (Portugal), 18-21 June, 2006 |
| Evolution of the structure of the XIST locus in mammals Kolesnikov N.N., Elisaphenko E.A., Zakian S.M. 5th International Conference on Bioinformatics of Genome Regulation and Structure (BGRS'2006), Novosibirsk, Russia (July 14-22) |
|
| Эволюция половых хромосом и происхождение центра инактивации X-хромосом млекопитающих Колесников Н.Н. IV Международная конференция " Проблема вида и видообразование". 25-28 сентября 2006. г. Томск. Томский Государственный Университет |
|
| Эволюция системы дозовой компенсации у млекопитающих Закиян С.М. IV Международная конференция " Проблема вида и видообразование". 25-28 сентября 2006. г. Томск. Томский Государственный Университет |
|
| The X-inactivation centre in common voles Shevchenko A., Malakhova A., Pavlova M., S. Slobodyanyuk S., Elisaphenko E., Mazurok N., Shilov A., Nesterova T., Brockdorff N., Zakian S. Вторая международная конференция по инактивации Х-хромосомы, Париж, Франция, 2006 |
|
| Эмбриональные стволовые клетки: свойства и особенности Закиян С.М. Международная конференции "Фундаментальные науки – биотехнологии и медицине" Новосибирск, Россия |
|
| О свойствах стволовых эмбриональных клеток Шевченко А.И., Мазурок Н.А., Шилов А.Г., Дёмина В.В., Дыбан П.А., Дыбан А.П., Закиян С.М. Международная конференция "Стволовые клетки и перспектива их использования в здравоохранении" Москва, Россия |
|
| Эволюция структурной организации Xist локуса у млекопитающих Колесников Н.Н., Елисафенко Е.А., Закиян С.М. Новосибирск, июль 16-22, 2006 год. Международная конференция по биоинформатике, регуляции и структуре генома. |
|
| X-linked genes mapping and expression status analysis in common voles Dementyeva E.V., Shevchenko A.I., Anopriyenko O.V., Mazurok N.A., Nesterova T.B., Zakian S.M. 2nd Conference on X-inactivation |
|
| Protein-coding genes surrounding Xist in mouse and human are separated in the American marsupials Monodelphis domestica and Didelphis virginiana Zakharova I.S., Shevchenko A.I., Elisaphenko E.A., Ross M., Weidman J., Jirtle R., Vandeberg J., Nesterova T., Karamysheva T., Rubtsov N., Zakian S, Brockdorff N. 2nd Conference on X-inactivation |
|
| X chromosome inactivation in trophoblast stem cells of common vole M.rossiaemeridionalis (Arvicolidae, Rodentia) N.A. Mazurok, E.V. Grigoreva, A.I. Shevchenko, P.A. Dyban, A.P. Dyban, S.M. Zakian. Вторая международная конференция по инактивации Х-хромосомы |
 Гранты
Гранты
| 2024 | Развитие коллекции культур клеток позвоночных в качестве базового депозитария российской коллекции типовых культур (RTCC) для обеспечения национальной технологической независимости и биобезопасности Министерство образования и науки Российской Федерации, номер гранта 075-15-2021-1063/10 от 27.04.2024 |
| 2023 | Роль PARP1 в развитии патологических процессов в нейронах при протеинопатиях РНФ, номер гранта 23-15-00224 |
| 2022 | Исследование патогенетического вклада генетических вариантов с неясным клиническим значением в генах саркомерных белков и генах RAS-сигнального каскада в развитие гипертрофической кардиомиопатии с использованием модели индуцированных плюрипотентных стволовых клеток и системы редактирования CRISPR/Cas9 РНФ |
| Создание моделей наследственной болезни Паркинсона на основе пациент-специфичных индуцированных плюрипотентных стволовых клеток Фонд научно-технологического развития Югры, номер гранта 2022-05-03/2022 |
|
| 2021 | Развитие коллекции культур клеток позвоночных в качестве базового депозитария российской коллекции типовых культур (RTCC) для обеспечения национальной технологической независимости и биобезопасности Министерство науки и высшего образования РФ, номер гранта 075-15-2021-1063 |
| 2019 | Создание клеточной платформы для исследования роли стресса эндоплазматического ретикулума в патогенезе спинальной мышечной атрофии РФФИ, номер гранта 20-34-70019 |
| Создание трансгенной линии плюрипотентных стволовых клеток крысы для получения индуцируемого нокаута микроРНК РНФ, номер гранта 19-74-00022 |
|
| Клеточная платформа для поиска и тестирования антипаркинсонических лекарственных препаратов РФФИ, номер гранта 19-29-04011 мк |
|
| Создание клеточных моделей болезни Хантингтона для изучения молекулярных механизмов развития патологии РНФ, номер гранта 16-15-10128П |
|
| Исследование механизма сенсибилизации опухолевых клеток ингибиторами тирозил-ДНК-фосфодиэстеразы 1 человека к действию известных противораковых препаратов РФФИ, номер гранта 19-415-540002 р_а |
|
| Платформа для создания релевантных моделей наследственных болезней c использованием индуцированных плюрипотентных стволовых клеток человека и системы CRISPR-Cpf1 РФФИ, номер гранта 19-44-540002 р_а |
|
| Поиск специфических метаболитов дофаминергических нейронов пациентов с болезнью Паркинсона РНФ, номер гранта 19-75-20063 |
|
| 2018 | Изучение клинического значения сверхчисленных маркерных хромосом человека с помощью молекулярно-цитогенетических методов анализа Номер гранта 19-015-00084 А |
| Исследование влияния мутаций в генах, ассоциированных с наследственной гипертрофической кардиомиопатией, на развитие данного заболевания с помощью пациент-специфичных индуцированных плюрипотентных стволовых клеток РНФ, номер гранта 18-75-10039 |
|
| 2017 | Разработка высокоэффективных молекулярногенетических подходов для коррекции спинальной мышечной атрофии РНФ, номер гранта № 17-75-10041 |
| «Исследование молекулярных механизмов HIF-зависимого ангиогенеза на модели эндотелиальных производных плюрипотентных стволовых клеток человека». РНФ, номер гранта РНФ № 17-75-10047 |
|
| 2016 | Создание клеточных моделей болезни Хантингтона для изучения молекулярных механизмов развития патологии РНФ, номер гранта 16-15-10128 |
| Анализ микроРНК, участвующих в регуляции самообновления плюрипотентных клеток крысы и процесса репрограммирования к плюрипотентному состоянию. РНФ, номер гранта 16-14-10084 |
|
| Получение и характеристика модельных систем бокового амиотрофического склероза с помощью плюрипотентных клеток человека, несущих мутации, связанные с развитием различных форм данного заболевания РФФИ, номер гранта 16-34-00762 мол_а |
|
| Получение вазопрессинэргических нейронов в результате направленной дифференцировки плюрипотентных стволовых клеток крыс линии Brattleboro с исправленным генотипом РФФИ, номер гранта 16-34-00887 |
|
| 2015 | Высокоточное картирование динамики молекулярно-генетических и эпигенетических событий, сопровождающих процессы инактивации и реактивации Х-хромосомы РФФИ, номер гранта 15-04-03947 А |
| 2014 | Разработка клеточных технологий для создания клеточно-наполненных сосудистых трансплантатов РФФИ, номер гранта 14-04-00082 А |
| Профиль инактивации транскрипции Х-хромосомы и роль гена Xist при импринтированной инактивации у грызунов РФФИ, номер гранта 14-04-00710 А |
|
| Изучение синдрома удлиненного QT-интервала сердечного ритма с помощью пациент-специфичных индуцированных плюрипотентных стволовых клеток РФФИ, номер гранта 14-04-31906 мол_а |
|
| 2012 | Исследование эпигенетического статуса Х-хромосомы в линиях плюрипотентных стволовых клеток человека РФФИ, номер гранта 12-04-31465 мол_а |
| Импринтировнная инактивация Х-хромосомы у грызунов: модификации хроматина и природа импринтинга РФФИ, номер гранта 12-04-31704 |
|
| Исследование феномена эпигенетической памяти при репрограммировании соматических клеток человека к плюрипотентному состоянию РФФИ, номер гранта 12-04-00185 |
|
| Создание клеточных моделей болезней экспансии тринуклеотидных повторов с применением новейших технологий геномной инженерии Номер гранта ФНМ-09 |
|
| Поиск подходов к коррекции мутантного фенотипа крыс Браттлборо с наследственным несахарным диабетом посредством применения плюрипотентных клеток с искусственно исправленным генотипом РФФИ, номер гранта 12-04-00208-a |
|
| 2011 | Регуляция инактивации Х-хромосомы у грызунов РФФИ, номер гранта 11-04-00799-а |
| Участие в 2-ой международной конференции по Х-инактивации с докладом «Инактивация Х-хромосомы в трофобластных стволовых клетках обыкновенной полевки M.rossiaemeridionalis (Arvicolidae, Rodentia)» РФФИ, номер гранта 06-04-58917-з |
|
| Участие в международном симпозиуме "50 лет исследования инактивации Х-хромосомы" РФФИ, номер гранта 11-04-09493 |
|
| Репрограммирование дифференцированных соматических клеток человека к плюрипотентному состоянию РФФИ, номер гранта 11-04-00847 |
|
| 2009 | Развитие технологии получения индуцированных стволовых клеток человека, пригодных для клеточной и генной терапии Президиум СО РАН |
| Федеральная целевая программа «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы. Научно-исследовательские работы по теме: «Исследование влияния экзогенной двуцепочечной ДНК человека на активацию и формирование противоракового адаптивного иммунитета и разработка принципиально новых подходов в использовании препарата нового поколения Панаген» Номер гранта Гос.контракт №02.740.11.0091 |
|
| Направленные изменения структуры генома - новый подход к управлению активностью генов Государственный контракт «Роснаука», номер гранта 02.512.11.2065 |
|
| Эпигенетические механизмы регуляции экспрессии генов эукариот в ходе онтогенеза Грант по программе «Молекулярная и клеточная биология», номер гранта Грант по программе «Молекулярная и клеточная биология» по проекту институтов СО РАН в программах РАН №22, подраздел 22.11 (№ А.II.6 в 2011 г.) |
|
| Изучение механизмов пространственно-временной устойчивости популяций филлофагов и разработка методов регуляции численности насекомых вредителей сельского и лесного хозяйства Грант по интеграционному междисциплинарному проекту СО РАН, номер гранта 46 |
|
| Трехмерные культуры клеток: исследование культивирования стволовых и первичных клеток с целью получения дифференцированной хрящевой ткани, пригодной для заместительной терапии Грант по проекту СО РАН, выполняемому совместно со сторонними организациями, номер гранта 59 |
|
| 2008 | Изменения структуры хроматина в процессе инактивации Х-хромосомы у обыкновенных полевок РФФИ, номер гранта 08-04-00346 |
| 2007 | Равенство полов или дозовая компенсация генов Х хромосом у самок плацентарных млекопитающих РФФИ, номер гранта 07-04-11508 |
| Разработка новых способов регуляции экспрессии генов у эукариот Государственный контракт, номер гранта 02.512.12.2018 |
|
| 2006 | Поиск и анализ центра инактивации X-хромосомы у сумчатых и насекомоядных РФФИ, номер гранта 06-04-48337-а |
| Структура и эволюция центра инактивации XIC/Xic X-хромосом млекопитающих Направление исследований №7 – «Генетические механизмы биологической эволюции и корреляция биогеологических событий», в рамках программы №18 «Происхождение и эволюция биосферы» (подпрограмма 2) |
|
| Стволовые клетки - основа клеточных биотехнологий будущего Междисциплинарный интеграционный проект фундаментальных исследований СО РАН, номер гранта 14.1 |
|
| 2005 | Анализ функционирования антисмысловых генов Xist/Tsix и их регуляторных элементов в центре инактивации Х-хромосомы у обыкновенных полевок Грант по программе «Молекулярная и клеточная биология» |
| Исследование экспрессии генов Oct4 и Nanog в плюрипотентных клетках обыкновенных полевок рода Microtus РФФИ, номер гранта 05-04-48692 |
|
| 2004 | Сравнительный анализ структурной организации терминальных районов хромосом ржи РФФИ, номер гранта 04-04-48813 |
 Научное руководство
Научное руководство
| 2024 | Изучение роли генетического варианта p.Asn515del в гене MYBPC3 на в развитии гипертрофической кардиомиопатии in vitro Проняева Ксения Александровна , 2024-06-18 |
| РАЗРАБОТКА КЛЕТОЧНОЙ МОДЕЛИ ДЛЯ АНАЛИЗА ВКЛАДА ГЕНЕТИЧЕСКОГО ВАРИАНТА с.1087G>T (p.G363С) В ГЕНЕ LGR4 В ПАТОГЕНЕЗ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ПРИ БОЛЕЗНИ ПАРКИНСОНА Подвысоцкая Валерия Сергеевна , 2024-06-13 |
|
| Изогенная клеточная модель для изучения влияния варианта гена GLUD2 с усиленной функцией в дофаминергических нейронах in vitro Шубкин Андрей Вячеславович , 2024-06-12 |
|
| Влияние ингибиторов PARP1 на развитие патологических процессов в срединных шипиковых нейронах, дифференцированных из индуцированных плюрипотентных стволовых клеток Макеева Владлена Сергеевна , 2024-06-10 |
|
| Вклад лейциновой киназы LRRK2 в развитие окислительного стресса дофаминергических нейронов, полученных из индуцированных плюрипотентных стволовых клеток Капитошина Елизавета Викторовна , 2024-06-08 |
|
| Проявления патогенного варианта p.N370S в гене GBA в нейральных производных ИПСК, полученных от пациентов с болезнью Паркинсона, и их коррекция с помощью фармакологических шаперонов Яркова Елена Сергеевна , 2024-06-08 |
|
| 2023 | Влияние генетического варианта c.1977G>A гена MYH7 с неясным клиническим значением на морфологию и физиологию кардиальных производных индуцированных плюрипотентных клеток Шульгина Ангелина Евгеньевна , 2023-06-07 |
| Подходы к оценке активности агонистов рецепторов, активируемых пероксисомными пролифераторами, in vitro Погосова Мария Артуровна , 2023-06-06 |
|
| 2022 | Характеристика регенеративного потенциала кардиальных стромальных клеток и кардиальных производных индуцированных плюрипотентных стволовых клеток человека Чепелева Елена Васильевна , 2022-10-26 |
| Влияние мутантной формы белка huntingtin на интерактом белков 14-3-3 в трансгенных линиях клеток HEK 293 FT Макеева Владлена Сергеевна , 2022-06-06 |
|
| 2021 | Создание и функциональный анализ клеточной модели бокового
амиотрофического склероза с помощью генетически-кодируемых биосенсоров Устьянцева Елизавета Ивановна , 2021-10-13 |
| Создание изогенных линий ИПСК с внесённой делецией p.Asn515del в ген MYBPC3 и изучение морфологии и физиологии их кардиальных производных Шаяхметова Лилия Шагитовна 2021-06-07 |
|
| 2020 | Характеристика клеточной модели спинальной мышечной атрофии Овечкина Вера Сергеевна , 2020-06-20 |
| Создание клеточной модели для исследования интерактомов белков 14-3-3ε и 14-3-3ζ при экспансии триплетов CAG в первом экзоне гена HTT Жданова Татьяна Юрьевна , 2020-06-16 |
|
| 2019 | Создание клеточной модели для исследования интерактома альфа-синуклеина Шарипова Динара Витальевна 2019-06-16 |
| Создание клеточной модели для исследования окислительно-восстановительного потенциала глутатиона в дофаминергических нейронах пациентов, страдающих болезнью Паркинсона Байрамова Эльвира Махаловна 2019-06-16 |
|
| Создание и характеристика линий индуцированных плюрипотентных стволовых клеток человека, несущих трансген программирумой нуклеазы Cpf1 (Cas12a) Вартанова Валерия Александровна 2019-06-14 |
|
| РАЗРАБОТКА ПОДХОДОВ К КЛИНИЧЕСКОМУ ПРИМЕНЕНИЮ ВАСКУЛЯРНЫХ КЛЕТОК ДЛЯ РЕГЕНЕРАЦИИ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ И ТКАНЕВОЙ ИНЖЕНЕРИИ СОСУДОВ Ступникова Алена Сергеевна 2019-06-14 |
|
| Эффекты эктопической экспрессии гена Xist в трофобластных стволовых клетках полевки Microtus levis Рифель Никита Андреевич , 2019-06-14 |
|
| 2018 | Получение кардиомиоцитов с использованием пациент-специфичных индуцированных плюрипотентных стволовых клеток для моделирования наследственной гипертрофической кардиомиопатии Югова Ксения Александровна 2018-06-06 |
| Получение генетически модифицированной линии плюрипотентных стволовых клеток человека, экспрессирующих HIF – фактор, индуцируемый гипоксией Смирнова Анна Михайловна , 2018-06-06 |
|
| Разработка системы коррекции однонуклеотидной замены с.840 C>T в 7 экзоне гена SMN2 Овечкина Вера Сергеевна , 2018-06-01 |
|
| 2017 | Применение геномной инженерии для прижизненной визуализации экспрессии маркеров нейральной дифференцировки плюрипотентных стволовых клеток человека Александров Андрей Алексеевич 2017-06-20 |
| «Мониторинг трансплантации кардиальных клеток в зону ишемического повреждения миокарда с использованием люциферазной репортерной системы» Милевская Елизавета Андреевна , 2017-06-19 |
|
| Создание клеточной модели болезни Хантингтона с использованием системы редактирования генома CRISPR/Cas9 Шарипова Динара Витальевна 2017-06-05 |
|
| 2016 | Создание модели наследственной гипертрофической кардиомиопатии на основе пациент-специфичных индуцированных плюрипотентных стволовых клеток человека Коваленко Виктория Романовна 2016-06-22 |
| Эпигенетический статус Х-хромосом в плюрипотентных стволовых клетках человека Стригина Евгения Валерьевна , 2016-06-01 |
|
| Разработка тканеинженерных конструкций, заселенных эндотелиальными и муральными клетками человека Смирнова Анна Михайловна , 2016-05-30 |
|
| 2015 | Создание системы исправления мутации di в культивируемых клетках крыс линии Brattleboro. Маланханова Туяна Баировна 2015-06-05 |
| Получение и характеристика эндотелиальных и муральных клеток человека и их использование на естественных и искусственных графтах сосудов Живень Мария Константиновна , 2015-06-04 |
|
| 2014 | Дифференцировка плюрипотентных стволовых клеток крысы и динамика процесса инактивации Х-хромосомы Герасимова К.В. , 2014-06-09 |
| 2012 | Исследование регенеративного потенциала культур клеток, полученных из экспланта сердечной мышцы человека Перовский Петр Петрович 2012-06-20 |
| Создание плазмидных и аденовирусных векторов, предназначенных для получения индуцированных плюрипотентных стволовых клеток человека Ковлягина Ирина Сергеевна , 2012-06-05 |
|
| 2011 | Центр инактивации Х-хромосомы обыкновенных полевок: характеристика последовательнгостей ДНК и анализ экспрессии генов Малахова Анастасия Александровна , 2011-11-29 |
| Регуляция транскрипции гена Tsix у домовой мыши и восточноевропейской полевки. Кузнецова Татьяна Олеговна , 2011-11-15 |
|
| Репрограмирование дифференцированных клеток крысы линии Wistar к состоянию плюрипотентности Стекленева Анастасия Евгеньевна , 2011-06-03 |
|
| Паттерн метилирования ДНК регуляторных областей генов Oct4 и Nanog полевки Microtus rossiaemeridionalis Филатова Анна Владимировна 2011-06-02 |
|
| Картирование сайтов инициации репликации в центре инактивации Х-хромосомы полевки Microtus rossiaemeridionalis Шерстюк В.В. , 2011-06-01 |
|
| Эпигенетический статус Х-хромосом в линиях индуцированных плюрипотентных стволовых клеток человека Грачева Е.А. , 2011-06-01 |
|
| Определение и анализ регуляторных районов гена Xist полевки Microtus rossiaemerisionalis Орищенко Константин Евгеньевич , 2011-04-06 |
|
| 2010 | Получение индуцированных плюрипотентных стволовых клеток человека из нейральных стволовых клеток Соболев Иван Андреевич 2010-06-03 |
| Гены центра инактивации и модификации хроматина активной и неактивной Х-хромосом у сумчатых Захарова Ирина Сергеевна , 2010-04-29 |
|
| Получение и характеристика трофобластных стволовых клеток обыкновенных полевок рода Microtus (Arvicolidae, Rodentia) Григорьева Елена Викторовна , 2010-04-28 |
|
| Статус экспрессии генов и модификации хроматина на активной и неактивной Х-хромосоме у обыкновенных полевок Дементьева Елена Вячеславовна , 2010-04-28 |
|
| 2009 | Экспрессия генов ранненго развития у обыкновенных полевок Сорокин М.А. , 2009-06-01 |
| Модификации хроматина неактивной Х-хромосомы у полевки Microtus rossiaemeridionalis Васькова Е.А. , 2009-06-01 |
|
| Статус экспрессии генов Х-хромосомы у обыкновенных полевок рода Microtus Вагнер Т.В. , 2009-06-01 |
|
| Функциональный анализ промоторной области гена Xist мыши (Mus musculus) Короткова Анна Михайловна , 2009-06-01 |
|
| Стуктура, регуляция и экспрессия генов Oct4 и Nanog у обыкновенных полевок рода Microtus (Arvicolidae, Rodentia) Медведев Сергей Петрович , 2009-01-28 |
|
| 2008 | ИССЛЕДОВАНИЕ РЕГУЛЯТОРНОЙ ОБЛАСТИ ГЕНА TSIX ПОЛЁВКИ MICROTUS ROSSIAEMERIDIONALIS Жукова Ольга Андреевна , 2008-06-02 |
| 2007 | Картирование точек инициации репликации в центре инактивации обыкновенных полевок Камнев А.Н. , 2007-06-01 |
| 2006 | ИССЛЕДОВАНИЕ РЕГУЛЯТОРНОЙ ОБЛАСТИ ГЕНА XIST ПОЛЁВКИ MICROTUS ROSSIAEMERIDIONALIS Орищенко Константин Евгеньевич , 2006-06-03 |
| 2004 | Получение эмбриональных стволовых (ЭС) клеток полевок рода Microtus и гибридов ЭС клеток мыши с соматическими клетками полевок Ситникова Наталья Анатольевна , 2004-06-01 |
 Учебные курсы
Учебные курсы
| 2023 | Применение геномных и клеточных технологий в генетических исследованиях и биомедицине Шевченко Александр Игоревич, Григорьева Елена Викторовна, Павлова Софья Викторовна, Захарова Ирина Сергеевна, Дементьева Елена Вячеславовна, Малахова Анастасия Александровна Дополнительное профессиональное образование, семестров: 1 |
| 2022 | «НАПРАВЛЕННАЯ ДИФФЕРЕНЦИРОВКА ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В НЕЙРАЛЬНЫЕ ПРОИЗВОДНЫЕ ИЦиГ СО РАН, курс повышения квалификации, семестров: 1 |
| 2018 | Физиология 21 века Медведев С. П., Мечетина Л. В.,Батурина Г. С.,Ланшаков Д. А., Бондарь Н. П., Гербек Ю. Э. Новосибирский Государственный Университет, кафедра физиологии, семестров: 1 |
| 2015 | Плюрипотентные клетки животных и человека Медведев С.П. ФГБНУ ФИЦ ИЦиГ СО РАН, Научно-образовательный отдел, семестров: 2 |
 Патенты
Патенты
| 2023 | Рекомбинантная плазмидная ДНК pSNCA-C-3XFLAG-2XST-donor, обеспечивающая стабильную доксициклин-управляемую экспрессию химерного белка альфа-синуклеина в культурах клеток человека Медведев С.П., Малахова А.А., Коваленко Л.В., Закиян С.М. Номер патента 2795156 |
| 2012 | Рекомбинантная плазмида pSN-ZsGreen, кодирующая белки SOX2 и NANOG человека и флуоресцентный белок ZsGreen, предназначенная для получения индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Шевченко А.И., Покушалов Е.А., Закиян С.М. |
| Рекомбинантная плазмида pOK-DsRed2, кодирующая белки OCT4 и KLF4 человека и флуоресцентный белок DsRed2, предназначенная для получения индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Шевченко А.И., Покушалов Е.А., Закиян С.М. |
|
| Рекомбинантная плазмида pOL-DsRed2, кодирующая белки OCT4 и LIN28 человека и флуоресцентный белок DsRed2, предназначенная для получения индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Шевченко А.И., Покушалов Е.А., Закиян С.М. |
|
| Рекомбинантная плазмида pAd-SM, кодирующая белки SOX2 и C-MYC человека, являющаяся основой для получения вирулентных аденовирусов, предназначенных для получения индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Шевченко А.И., Покушалов Е.А., Закиян С.М. |
|
| Рекомбинантная плазмида pSM-ZsGreen, кодирующая белки SOX2 и C-MYC человека и флуоресцентный белок ZsGreen, предназначенная для получения индуцированных плюрипотентных стволовых клеток человека Медведев С.П., Шевченко А.И., Покушалов Е.А., Закиян С.М. |
| © 2010-2026 ИЦиГ СО РАН. Все права защищены. |