Система учета научной деятельности (ASSA) |


|
Лаборатория биоинженерии растений (т.16)Отдел молекулярных биотехнологий
Научные результаты Сотрудники О Подразделении 1. Основное направление фундаментальных и фундаментально-ориентированных исследований Разработка технологии создания продуцентов кандидатных субъединичных съедобных вакцин против Mycobacterium tuberculosis на основе генетически модифицированных растений моркови и оптимизация экспрессии целевых генов. Изучение межклеточных контактов и динамики цитоскелета в материнских клетках микроспор на моделях трансгенных растений и разноплоидных линиях табака.
2. Задачи, решаемые в настоящее время в рамках базового бюджетного проекта
3. Прикладные разработки В лаборатории разработаны генетические конструкции с генами esat6 и cfp10 M.tuberculosis и геном dIFN человека, разработан способ получения трансгенных растений моркови и способ культивирования клеточной культуры табака. Разработки защищены патентами.
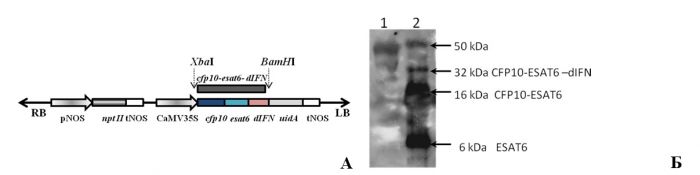
4. Иллюстрированное описание лучших результатов, полученных подразделением за последние 5 лет Разработаны три типа генетических конструкций с генами cfp10 и esat6 M.tuberculosis, в двух из которых целевые гены были представлены в виде индивидуальных генов и в третьей (рис.1 А) – в слитой форме с добавлением гена дельтаферона человека для экспрессии в клетках растений (Патент №2468082 от 27 ноября 2012 г.). Включение гена дельтаферона человека в состав генетической конструкции предполагало использование рекомбинантного дельтаферона в качестве адьюванта и иммуномодулятора, усиливающего иммунный ответ к антигенам M.tuberculosis. Дельтаферон является рекомбинантным аналогом γ-интерферона человека, синтезируется в растворимой нативной форме, имеет повышенную устойчивость к протеазам крови и сниженную противовирусную активность.
Рисунок 1. Схема генетической конструкции химерного гена cfp10-esat6-dIFN для экспрессии в клетках растений (А) и продукты его экспрессии (Б), выявляемые Вестерн-блот анализом экстрактов (суммарный растворимый белок) из корнеплодов трансгенных растений моркови Обозначения: RB и LB – повторы, окаймляющие Т-область плазмиды; pNOS и tNOS - промотор и терминатор гена нопалинсинтазы Тi-плазмиды A.tumefaciens; nptII – ген неомицинфосфо-трансферазы II E.coli; CaMV35S – промотор гена 35S РНК вируса мозаики цветной капусты; cfp10 и esat6 – гены секреторных белков M.tuberculosis; dIFN – ген дельтаферона человека; uidA – ген бета-глюкуронидазы E.coli. Стрелками указаны сайты рестрикции BamHI и XbaI. 1- (контроль) - очищенный rCFP-10-ESAT-6-dIFN, наработанный в E. сoli (10 нг); 2 - экстракт корнеплодов трансгенной моркови. Справа указаны молекулярные массы визуализируемых фрагментов и их предполагаемый состав.
Разработан способ получения трансгенных растений моркови (Патент №2374321 от 27 ноября 2009). Получены линии трансгенной моркови, в тканях корнеплодов которых синтезировались рекомбинантные белки M. tuberculosis и химерный (рис. 1 Б) рекомбинантный белок (ESAT6 - 0,056% ОРБ; CFP10 - 0,002 %; CFP-10-ESAT-6-dIFN – 0.058%). Продемонстрировано формирование клеточного и гуморального иммунных ответов при пероральной доставке исследуемых рекомбинантных CFP10- и ESAT6-иммуногенов экспериментальным животным. Установлено, что исследуемые иммуногены способны синтезироваться в растительных клетках, накапливаться в тканях растений на уровне, достаточном для формирования иммунного ответа и сохранять свои биологические свойства при прохождении через желудочно-кишечный тракт животных. Формирование иммунного ответа при пероральной доставке рекомбинантного CFP10, синтезируемого в тканях корнеплодов трансгенных растений моркови, выявлено нами впервые. Установлено, что ESAT6 проявлял токсичность по отношению к мононуклеарам периферической крови. Мы предположили, что токсичность ESAT6 может быть снижена в присутствии адьюванта, в качестве которого нами был использован дельтаферон человека.
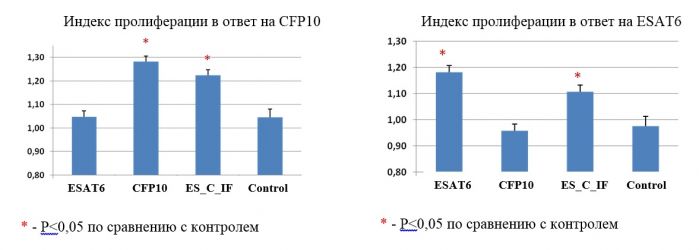
Установлено, что химерный белок CFP10-ESAT6-dIFN обладал способностью индуцировать гуморальные и клеточные звенья иммунитета при пероральном (корнеплоды трансгенной моркови) и инъекционном (очищенный рекомбинантный белок, синтезируемый в E.coli) введении в организм животных (самцы мышей в возрасте 6-7 недель инбредной линии BALB/c, SPF-виварий ИЦиГ СО РАН, Новосибирск). На рисунке 2 представлены результаты оценки клеточного звена иммунитета у исследуемых животных при пероральной доставке антигенов. Добавление рекомбинантных CFP10 (рис 2, слева) и ESAT6 (рис 2, справа) к сывороткам крови мышей, получавших в эксперименте исследуемые иммуногены перорально, стимулировало пролиферацию лимфоцитов независимо от того, как был представлен иммуноген – индивидуально либо в составе химерного белка (различия достоверны при P<0,05 по сравнению с контролем).
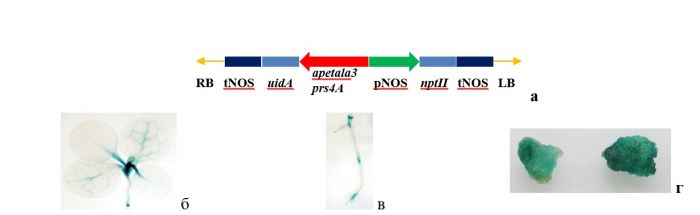
Рисунок 2. Оценка клеточного звена иммунитета у мышей в ответ на CFP10 (слева) и ESAT6 (справа) при пероральной доставке иммуногенов (в составе моркови. Обозначения: ES_C_IF – химерный белок ESAT6-CFP10-dIFN; control – нетрансгенные растения моркови. Принципиально важно, что рекомбинантный ESAT6 в составе химерного белка не оказывал цитотоксического эффекта в отношении мононуклеаров периферической крови, что подтвердило правильность выбора дельферона в качестве адьюванта. Дельтаферон в составе химерного белка оказывал пролиферативное влияние на спленоциты неиммунизированных мышей, что подтверждало его биологическую активность. Установлено, что пероральная доставка CFP10-ESAT6-dIFN-антигена не отличалась по стимуляции клеточного иммунитета от эффективности, наблюдаемой при инъекциях соответствующего рекомбинантного химерного белка. Это особенно важно, поскольку именно Th1-тип иммунного ответа играет ведущую роль в противостоянии организма заражению M. tuberculosis. Важным итогом выполненных работ является первая демонстрация того, что морковь, корнеплоды, которой можно использовать в пищу без термообработки, в дальнейшем может составить платформу для создания кандидатной съедобной субъединичной рекомбинантной вакцины. Созданы генетические конструкции с промоторами (apetala3 и prs4A) тканеспецифичных генов A.thaliana на основе плазмиды pNPB-TS (рис. 3 а), обеспечивающие экспрессию репортерного uidA-гена в активно делящихся клетках табака: в зоне апикальных (рис. 3 б) и корневых меристем (рис. 3 в). Созданные конструкции предназначены для усиления экспрессии целевых генов у трансгенных растений в активно делящихся клетках апикальных и корневых меристем, в том числе в клетках каллусов. Способность промотора обеспечивать экспрессию в активно делящихся клетках представляет интерес для получения высокоэффективных клеточных линий как продуцентов фармацевтически ценных белков, поскольку скорость деления клеток может регулироваться in vitro экзогенными факторами. Способ культивирования клеточной линии табака in vitro защищен патентом (Патент №2354692 от 10 мая 2009 г.). Гистохимическое определение активности β-глюкуронидазы подтвердило экспрессию uidA-гена в клетках каллусов (рис. 3 г; голубое окрашивание). Созданные генетические конструкции предусматривают возможность замены репортерного гена на последовательности целевых генов.
Рисунок 3. Генетическая конструкция и варианты экспрессии uidA-гена в тканях трансгенных растений и каллусов табака. a – схема генетической конструкции для тканеспецифической экспрессии трансгенов в растениях; б, в – uidA-экспрессия (голубое окрашивание) в апикальной меристеме и меристеме корней у проростков трансгенного табака; г – uidA-экспрессия (голубое окрашивание) в каллусных тканях трансгенного табака; (Обозначения: RB и LB – повторы, окаймляющие Т-область плазмиды; pNOS - промотор гена нопалинсинтазы Тi-плазмиды A.tumefaciens; nptII – ген неомицинфосфо-трансферазы II E.coli; tNOS - терминатор гена нопалинсинтазы Тi-плазмиды A.tumefaciens; uidA – последовательность гена бета-глюкуронидазы E.coli).
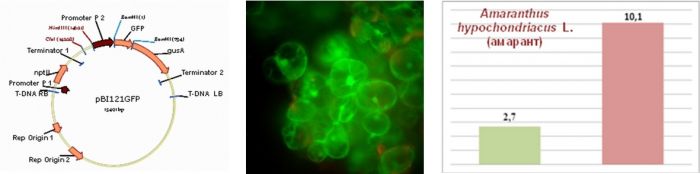
Проведен отбор клеточных линий нескольких видов растений по скорости нарастания биомассы in vitro, как одного из этапов разрабатываемой в лаборатории технологии получения рекомбинантных фармацевтически ценных белков в растительных системах на основе клеточных суспензионных культур. Создана генетическая конструкция (Рис. 4 а) с геном GFP зеленого флюоресцирующего белка (Рис. 4 б), что позволило количественно оценивать уровень накопления рекомбинантного белка. Отобрана клеточная линия амаранта (Рис. 4 в), характеризующаяся высокой скоростью накопления биомассы клеток (десятикратное увеличение биомассы клеток за 15 дней культивирования).
Рисунок 4. Разработка биоинженерной платформы нового поколения для экспрессии целевых генов в суспензионных культурах клеток генетически модифицированных растений: а - схема вектора с маркерным геном GFP; б - флюоресценция GFP-белка; в - прирост биомассы клеток амаранта в суспензионной культуре на 10-ый и 15-ый день культивирования.
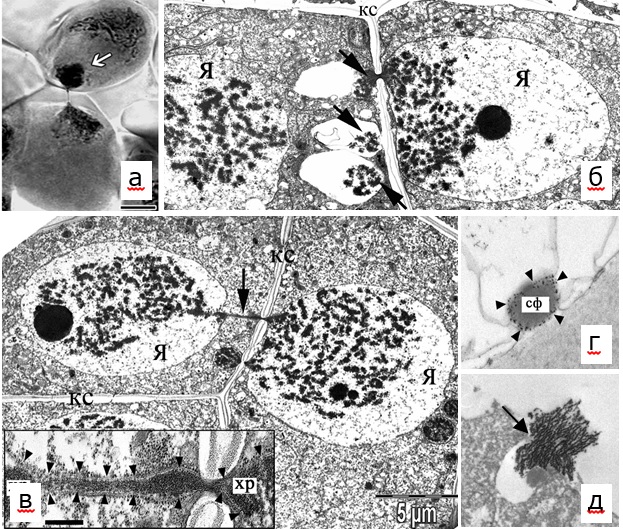
При создании трансгенных растений табака выделены уникальные линии с высоким уровнем (более 40%) цитомиксиса, используемые в качестве моделей для изучения фундаментальной проблемы межклеточных взаимодействий. Цитомиксис, или межклеточное перемещение ядер по цитомиктическим каналам (рис. 4 а), исследован на клеточном и ультраструктурном уровнях. Впервые показано, что перемещение ядер не связано с нарушениями функций тубулинового цитоскелета и происходит без нарушения ядерной оболочки (рис. 4 б). Результатом цитомиксиса может быть слияние оболочки перемещающегося ядра с оболочкой ядра клетки-реципиента и образование межъядерного мостика (рис. 4 в). Впервые установлено, что формирование цитомиктических каналов происходит с участием сферосомоподобных везикул (рис. 4 г), содержимое которых обладает ферментативной активностью (рис. 4 д).
Рисунок 4. Цитомиксис в материнских клетках микроспор табака (а – световая микроскопия, б-д – электронная микроскопия). а, б – цитомиксис (стрелки) в профазе 1 мейоза; в – стрелкой указан сформированный межъядерный мостик, на врезке представлен его увеличенный фрагмент; г – сферосомоподобная везикула; д – распад везикулы и выделение фермента каллазы при формировании межклеточного цитомиктического канала (указано стрелкой). Обозначения: я – ядро; кс – клеточная стенка; хр – хроматин; сф – сферосомоподобная везикула. Для детального исследования причин и механизмов межклеточных взаимодействий в лаборатории создана коллекция разноплоидных линий табака (гаплоиды, триплоиды и тетраплоиды).
5. Задачи, планируемые на перспективу Дальнейшие работы коллектива лаборатории направлены на совершенствование генетической конструкции для повышения уровня экспрессии химерного рекомбинантного белка в тканях трансгенных растений. Полученный нами химерный белок CFP10-ESAT6-dIFN безусловно представляет интерес в качестве кандидатной съедобной вакцины и нуждается в дальнейших дополнительных исследованиях. Следующим этапом нашей работы предполагаются исследования по разработке и совершенствованию генетической конструкции с геном cfp10-esat6-dIFN. Планируется усиление иммуногенности CFP10-ESAT6-dIFN за счет слияния с CTB-антигеном, а также проведение генно-инженерных работ по введению фрагментов ДНК, кодирующих аминокислотные последовательности, обеспечивающие связывание рекомбинантного химерного белка с поверхностями аффинных носителей. Для защиты целевого рекомбинантного белка от протеолитических ферментов клеток растений планируется обеспечение его локализации в люменах эндоплазматического ретикулума. Предусматривается сравнительный анализ формирования пулов СD4+ и CD8+ T-клеток у лабораторных животных (мыши) в зависимости от способов доставки рекомбинантного химерного белка (CFP10-ESAT6-dIFN). Предполагается оценить соотношение СD4+/CD8+ T-клеток при пероральной доставке CFP10-ESAT6-dIFN в организм мышей (съедобная вакцина) и при доставке CFP10-ESAT6-dIFN в организм мышей в виде фрагмента ДНК (ДНК-вакцина). Планируется исследование характеристик рекомбинантного химерного белка, синтезируемого в тканях корнеплодов трансгенных растений моркови, таких как сохранение его иммуногенных характеристик в зависимости от длительности хранения корнеплодов моркови, а также при лиофилизации тканей корнеплодов. Конечной целью данной работы является разработка новой безопасной и эффективной кандидатной вакцины от туберкулеза, которая могла бы заменить или дополнить вакцину БЦЖ для интактных или привитых штаммом БЦЖ детей, взрослых и животных. В рамках направления по созданию трансгенных растений в качестве биопродуцентов рекомбинантных белков будут закончены работы по оценке эффективности использования тканеспецифичных промоторов для экспрессии трансгенов в растительных меристемах. Созданные генетические конструкции предусматривают возможность замены репортерного гена на другие последовательности. Это позволит использовать их для создания клеточных культур, обеспечивающих повышенный уровень экспрессии целевых генов и накопление рекомбинантных белков в активно делящихся клеточных культурах. Планируется продолжение анализа цитомиксиса в микроспорогенезе растений с использованием созданных в лаборатории разноплоидных линий табака. Так как цитомиксис это процесс миграции ядер между растительными клетками, который, как предполагается, имеет эволюционное значение, оказывая влияние на качественный состав продуктов мейоза путем формирования анеу-, ди- и полиплоидных гамет, то изучение клеточных механизмов, причин и последствий цитомиксиса является важной фундаментальной проблемой биологии развития, клеточной биологии и межклеточной коммуникации растений. Выявление и понимание клеточных механизмов цитомиксиса, возможно, будет иметь значение для решения прикладных задач репродуктивной биологии, поскольку аномально высокая частота цитомиксиса является одним из основных нарушений мейоза у гибридных и полиплоидных форм хозяйственно-ценных растений. В рамках данной работы на ближайшие 5 лет планируется: 1) проанализировать мигрирующий между клетками при цитомиксисе хроматин, выявить какие хромосомы мигрируют между клетками и в каком функциональном состоянии находится хроматин при цитомиксисе; 2) определить, какова дальнейшая судьба мигрировавшего хроматина после цитомиксиса; 3) установить, присутствуют ли в клетках после цитомиксиса маркеры программируемой клеточной гибели; 4) продолжить анализ клеточных механизмов миграции ядер между растительными клетками на ультраструктурном уровне. Для проведения вышеперечисленных работ будет использованы метод FISH, анализ посттрансляционной модификации гистонов, TUNEL-анализ и методы высокоразрешающей электронной микроскопии Будут продолжены исследования роли и взаимодействия актиновой и тубулиновой форм цитоскелета в регуляции деления растительных клеток и межклеточных взаимодействий на примере материнских клеток микроспор трансгенных растений табака. К настоящему времени стало очевидным, что существующие методы визуализации различных форм растительного цитоскелета (введение меченых мономеров, иммунофлюоресцентное окрашивание с использованием антител), несмотря на достаточно высокую разрешающую способность, имеют ряд существенных недостатков. В частности к ним относятся невозможность прижизненного окрашивания цитоскелета и невозможность одновременной визуализации в микроспорогенезе тубулина и актина, что связано с особенностями фиксации последнего. Выходом из положения является создание трансгенных растений, экспрессирующих химерные гены, в которых кодирующая последовательность репортерного белка GFP слита с последовательностью, кодирующей домен связывания с актином/тубулином. Учитывая, что известные конститутивные промоторы не обеспечивают уровня экспрессии, достаточного для визуализации цитоскелетных структур в материнских клетках микроспор, для визуализации цитоскелета кодирующие последовательности маркерных генов будут поставлены под управление промоторов, обладающих специфической активностью в микроспорогенезе Абхаирова Анна Юрьевна [лаборант] Белавин Павел Александрович [научный сотрудник] Загорская Алла Алексеевна [научный сотрудник] Краев Владислав Юрьевич [лаборант] Кузнецова Ольга Владимировна [старший лаборант] Маренкова Татьяна Владиславовна [научный сотрудник] Мурсалимов Сергей Рамильевич [старший научный сотрудник] Пермякова Наталья Владиславовна [старший научный сотрудник] Сидорчук Юрий Владимирович [научный сотрудник] Уварова Елена Александровна [научный сотрудник] Франкевич Татьяна Андреевна [младший научный сотрудник] Цмокалюк Дмитрий Антонович [лаборант] Бывшие сотрудникиБарабошкина Анастасия ВасильевнаВолкова Оксана Анатольевна Денисова Эмма Васильевна Жариков Тимофей Юрьевич Зибзеев Евгений Григорьевич Знак Ольга Владимировна Коваленко Иван Сергеевич Кольченко Татьяна Ильинична Конопкина Людмила Алексеевна Леонова Анастасия Владиславовна Моисеенко Алена Валерьевна Нестеров Андрей Егорович Носарева Олеся Валерьевна Попова Инна Сергеевна Похмельных Галина Аркадьевна Ренгач Наталья Сергеевна Розов Сергей Михайлович Сидоров Александр Никитич Сметанина Люся Павловна Смирнов Евгений Александрович Смышляева Руфина Соломоновна Стенькина Татьяна Станиславовна Хайрулина Елена Сергеевна Шамина Наталия Владимировна Шаталина Маргарита Николаевна Шелемба Арсения Александровна Щербаков Дмитрий Николаевич СовместителиКузнецов Виталий Викторович [научный сотрудник]Лукин Александр Дмитриевич [лаборант] Орлова Екатерина Анатольевна [старший лаборант] Хорзова Алиса Алексеевна [лаборант] Выберите слайдером нужный промежуток, и список ниже будет содержать записи только нужного периода: 97 98 99 00 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Публикации Монографии Конференции Гранты Научное руководство Учебные курсы Патенты
|
| 2019 | Вариабельность по экспрессии GFP- гена в моноклональных клеточных линиях Arabidopsis thaliana Т.В. МАРЕНКОВА, Ю.В. СИДОРЧУК, А.В. НОСОВ, А.А. ФОМЕНКОВ, В.В. КУЗНЕЦОВ, С.Р. МУРСАЛИМОВ, А.А. ЗАГОРСКАЯ, Е.А. УВАРОВА, П.А. БЕЛАВИН, Е.В. ДЕЙНЕКО Биотехнология, 2019, Т. 35, № 1, С. 58–67 |
| СТРАТЕГИИ ОПТИМИЗАЦИИ СИНТЕЗА РЕКОМБИНАНТНЫХ БЕЛКОВ
В РАСТИТЕЛЬНЫХ КЛЕТКАХ: КЛАССИЧЕСКИЕ ПОДХОДЫ
И НОВЫЕ НАПРАВЛЕНИЯ Розов С.М., Дейнеко Е.В. Molecular Biology, 2019, т. 53, N 2, с. 179-199. |
|
| Strategies for Optimizing Recombinant Protein Synthesis
in Plant Cells: Classical Approaches and New Directions Розов С.М., Дейнеко Е.В. Molecular Biology, 2019, V. 53, N 2, p. 157-175 |
|
| The Problem of the Low Rates of CRISPR/Cas9-Mediated Knock-ins in Plants: Approaches and Solutions. Rozov S.M., Permyakova N.V., Deineko E.V. INT J MOL SCI, 2019, V. 20 A. 3371 |
|
| 2018 | Evaluation of DNA damage in tobacco male meiocytes involved in cytomixis using comet assay Sergey Mursalimov, Alla Zagorskaya, Elena Deineko PROTOPLASMA, 2018, 255(1):413-417 |
| Cytomixis in plants: facts and doubts Sergey Mursalimov, Elena Deineko PROTOPLASMA, 2018, 255:719-731 |
|
| Основные стратегии гликоинженерии растительных систем экспрессии для получения гуманизированных рекомбинантных фармацевтических белков. Розов С.М., Пермякова Н.В., Дейнеко Е.В. Биохимия, 2018, т. 83 вып. 3 стр. 328-348 |
|
| The recombinant fusion protein CFP10–ESAT6–dIFN has protective effect against tuberculosis in guinea pigs Permyakova N.V., Belavin P.A., Pirozhkova D.S., Ufimtseva E.G., Rozov S.M., Mursalimov S.R., Sidorchuk Y.V., Uvarova E.A., Zagorskaya A.A., Marenkova T.V., Bannikova S.V., Demidov E.A., Starostin K.V., Kravchenko M.A., Vakhrusheva D.V., Berdnikov R.B., Eremeeva N.I., Skornyakov S.N., Peltek S.E., Deineko E.V. ACTA MICROBIOL IMM H, 2018, v. 65 p. 39-58 |
|
| FlowerMorphology: fully automatic flower morphometry software Rozov S.M., Deineko E.V., Deyneko I.V. PLANTA, 2018, v. 247 p. 1163-1173 |
|
| Main Strategies of Plant Expression System Glycoengineering
for Producing Humanized Recombinant Pharmaceutical Proteins Rozov S.M., Permyakova N.V., Deineko E.V. BIOCHEMISTRY-MOSCOW+, 2018, v. 83 N 3 p. 215-232 |
|
| Transient Gene Expression for the Characteristic Signal Sequences and the Estimation of the Localization of Target Protein in Plant Cell Berestovoy M., Tyurin A., Kabardaeva K., Sidorchuk Y., Fomenkov A., Nosov A., Goldenkova-Pavlova I. Bio-protocol, 2018, Vol 8. Iss 04. Feb 20 |
|
| Инактивация гена GFP при помощи
системы CRISPR/Cas9 в культуре
суспензионных клеток Arabidopsis
Thaliana Н.В. Пермякова, Ю.В. Сидорчук, Т.В. Маренкова, С.А. Хозеева, А.А. Загорская, Е.В. Дейнеко Гены и клетки, 2018, Приложение, №2, с. 84-85 |
|
| Исследование агрегативности суспензионной клеточной культуры Arabidopsis thaliana с нокаутом
гена GAUT1 Ю.В. Сидорчук, А.С. Щелокова, Н.В. Пермякова, Е.В. Дейнеко Гены и клетки, 2018, Приложение, №2, с. 47 |
|
| Migration of DNA-Containing Organelles between Tobacco
Microsporocytes during Cytomixis S. R. Mursalimov, Yu. V. Sidorchuk, A. A. Zagorskaya, E. V. Deineko RUSS J DEV BIOL+, 2018, Vol. 49, No. 3, pp. 159–165 |
|
| 2017 | Analysis of cytomixis in tobacco microsporocytes with confocal laser scanning microscopy Sergey Mursalimov, Yuri Sidorchuk, Elena Deineko PROTOPLASMA, 2017, 254(1):539-545 |
| Cytomixis in tobacco microsporogenesis: are there any genome parts predisposed to migration? Sergey Mursalimov, Elena Deineko PROTOPLASMA, 2017, 254:1379-1384 |
|
| Простая и надежная система транзиентной экспрессии генов для характеристики сигнальных последовательностей и оценки локализации целевых белков в растительной клетке ТЮРИН А.А., КАБАРДАЕВА К.В., БЕРЕСТОВОЙ М.А., СИДОРЧУК Ю.В., ФОМЕНКОВ А.А., НОСОВ А.В., ГОЛДЕНКОВА-ПАВЛОВА И.В. Физиология растений, 2017, Том: 64, Номер: 5, Страницы: 363-371 |
|
| Behavior of nucleolus in the tobacco male meiocytes involved in cytomixis Sergey Mursalimov, Yuriy Sidorchuk, Elena Deineko CELL BIOL INT, 2017, 41(3):340–344 |
|
| Cytoskeletal mechanisms in positioning of the second-division spindles and meiotic restitution in tobacco (Nicotiana tabacum L.) microsporogenesis Sidorchuk Y.V., Deineko E.V. CELL BIOL INT, 2017, 41(6):669-679 doi: 10.1002/cbin.10772 |
|
| Регуляторные элементы для экспрессии трансгенов в меристемах растений Сидорчук Ю.В., Герасименко И.М., Шелудько Ю.В., Дейнеко Е.В. Вестник НГАУ, 2017, №4(№45), с. 66-74 |
|
| СУСПЕНЗИОННЫЕ КУЛЬТУРЫ КЛЕТОК РАСТЕНИЙ КАК ПЛАТФОРМА ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ Загорская А.А., Дейнеко Е.В. Физиология растений, 2017, том 64, № 6, с. 403–417 |
|
| ОПТИМИЗАЦИЯ ПАРАМЕТРОВ РОСТА КЛЕТОЧНЫХ ЛИНИЙ НЕКОТОРЫХ ВИДОВ ДВУДОЛЬНЫХ РАСТЕНИЙ В УСЛОВИЯХ СУСПЕНЗИОННОЙ КУЛЬТУРЫ Загорская А.А., Сидорчук Ю.В., Дейнеко Е.В. Вестник НГАУ, 2017, № 4 (45):41-49 |
|
| Зачем ядро сбегает из клетки? цитомиксис в мейозе высших растений С.Р. Мурсалимов, Е.В. Дейнеко Цитология, 2017, 59 (11) : С. 778 |
|
| Растительные системы экспрессии в качестве продуцентов рекомбинантных фармацевтически ценных белков Дейнеко Е.В., Загорская А.А. Vavilov journal of genetics and breeding, 2017, 21(8):979-985 |
|
| Создание кандидатной вакцины против клещевого энцефалита на основе гибридного рекомбинантного flagG-protE-белка Белавин П.А., Кунык Д.А., Протопопова Е.В., Локтев И.Б., Дейнеко Е.В. Vavilov journal of genetics and breeding, 2017, 21(8):986-992. DOI 10.18699/VJ17.323 |
|
| Suspension-Cultured Plant Cells as a Platform for Obtaining Recombinant Proteins Загорская А.А., Дейнеко Е.В. RUSS J PLANT PHYSL+, 2017, Vol. 64, No. 6, pp. 795–807 |
|
| Strategies for designing novel tuberculosis vaccines Rozov S.M., Deineko E.V. Biology Bulletin Reviews, 2017, Vol. 7, p.113-128. |
|
| Simple and Reliable System for Transient Gene Expression for the Characteristic Signal Sequences and the Estimation of the Localization of Target Protein in Plant Cell A.A. Tyurin, K.V. Kabardaevaa, M.A. Berestovoya,Yu.V. Sidorchukc, A.A. Fomenkova, A.V. Nosova, I.V. Goldenkova-Pavlova RUSS J PLANT PHYSL+, 2017, 2017, Vol. 64, No. 5, pp. 672–679 |
|
| 2016 | Bacterial Intracellular Pathogens: Offense and Defense Strategies. Rozov S.M., Deineko E.V. Biology Bulletin Reviews, 2016, V. 6 N2 P. 189-201 |
| Mycobacterium tuberculosis: стратегии нападения и защиты Розов С.М., Дейнеко Е.В. Успехи современной биологии, 2016, Т. 136 N1 С. 26-41 |
|
| A rise of ploidy level influences the rate of cytomixis in tobacco male meiosis Sergey Mursalimov, Yuri Sidorchuk, Dmitri Demidov, Armin Meister, Elena Deineko PROTOPLASMA, 2016, 253:1583-1588 |
|
| Mycobacterium tuberculosis: Strategies of offense and defense. Rozov S.M., Deineko E.V. Biology Bulletin Reviews, 2016, Vol. 6, № 4, P. 276–288. |
|
| Иммунитет против Mycobacterium tuberculosis: стратегии нападения и защиты. Розов С.М., Попова Н.А., Дейнеко Е.В. Успехи современной биологии, 2016, Т. 136, № 2, С. 156–172 |
|
| Intra- and Intertissular Cytomictic Interactions in the Microsporogenesis of Mono- and Dicotyledonous Plants E.A. Kravets, Yu.V. Sidorchukb, I.I. Horyunovaa, S.H. Plohovskaya, S.R. Mursalimov, E.V. Deineko, A.I. Yemets, Ya.B. Blume CYTOL GENET+, 2016, Vol. 50, No. 5, pp. 267–277 |
|
| Стратегии конструирования новых вакцин против туберкулеза. Розов С.М., Дейнеко Е.В. Успехи современной биологии, 2016, Т. 136, N 5, С. 472-491 |
|
| Гибридологический анализ наследования мозаичного характера экспрессии nptII- гена у трансгенных растений табака Маренкова Т.В., Дейнеко Е.В Генетика, 2016, Т. 52. № 6. С.641-649 |
|
| Оценка эффективности использования температурного стресса для индукции цитомиксиса в микроспорогенезе двудольных (N. tabacum L.) и однодольных (H. distichum L.) растений Ю.В. Сидорчук, Е. А. Кравец, С.Р. Мурсалимов, С.Г. Плоховская, И.И. Горюнова, А.И. Емец, Я.Б. Блюм, Е.В. Дейнеко Онтогенез, 2016, Т.47. №6. С. 357-372 |
|
| Efficiency of the Induction of Cytomixis in the Microsporogenesis of Dicotyledonous (N. tabacum L.) and Monocotyledonous (H. distichum L.) Plants by Thermal Stress Yu.V. Sidorchuk, E.A. Kravets, S.R. Mursalimov, S.G. Plokhovskaya I.I. Goryunova, A.I. Yemets, Y.B. Blume, and E.V. Deineko RUSS J DEV BIOL+, 2016, Vol. 47, No. 6, pp. 335–347. |
|
| Вариабельность накопления S-антигена вируса гепатита B в корнеплодах и листьях индивидуальных трансгенных растений моркови Уварова Е. А. , Загорская А. А. , Поздняков С. Г. , Дейнеко Е. В. , Щелкунов С. Н. Вестник Томского государственного университета. Биология., 2016, № 1 (33). C. 126–139. |
|
| Immunity against Mycobacterium tuberculosis: Defense strategies Rozov S.M., Popova N.A., Deineko E.V. Biology Bulletin Reviews, 2016, Vol. 6 p. 483-496 |
|
| Внутри- и межтканевые цитомиктические взаимодействия в микроспорогенезе одно- и двудольных растений Кравец Е.А., Сидорчук Ю.В., Горюнова И.И., Плоховская С.Г., Мурсалимов С.Р., Дейнеко Е.В., Емец А.И., Блюм Я.Б. Цитология и генетика, 2016, 2016, том 50, № 5, C. 3-16 |
|
| Hybridological analysis of inheritance of mosaic nptII gene expression in transgenic tobacco plants Marenkova T.V., Deineko E.V. RUSS J GENET+, 2016, Т. 52. № 6. С. 557-564 |
|
| Трансгенные растения как продуценты химерного CFP10-ESAT6-dIFN
белка против Mycobacterium tuberculosis Белавин П.А.1, Уфимцева Е.Г.2, Уварова Е.А.1, Мурсалимов С.Р.1, Сидорчук Ю.В.1, Розов С.М.1, Пермякова Н.В.1, Загорская А.А.1, Маренкова Т.В.1, Банникова С.В.1, Демидов Е.А.1, Старостин К.В.1, Кравченко М.А.3, Вахрушева Д.В.3, Бердников Р.Б.3, Еремеева Н.И.3, Скорняков С.Н.3, Пельтек С.Е.1, Дейнеко Е.В. ТРАНСГЕННЫЕ РАСТЕНИЯ: технологии создания, биологические свойства, применение, биобезопасность: сборник статей по материалам VI Всероссийского симпозиума (16-21 ноября 2016 г.). — Москва, ИФР РАН, 2016., 2016, С. 39-42 |
|
| Cytomixis in the cereal (Gramineae) microsporogenesis Yuri V. Sidorchuk, Anna A. Novikovskaya, Elena V. Deineko PROTOPLASMA, 2016, 253:291–298,DOI 10.1007/s00709-015-0807-4 |
|
| 2015 | Cytomixis doesn’t induce obvious changes in chromatin modifications and programmed cell death in tobacco male meiocytes Mursalimov S, Permyakova N, Deineko E, Houben A and Demidov D Frontiers in Plant Science, 2015, 6:846. doi: 10.3389/fpls.2015.00846 |
| ФРАГМЕНТЫ ВЕКТОРНОЙ ДНК, ИНТЕГРИРУЮЩИЕСЯ В ГЕНОМ ТРАНСГЕННЫХ РАСТЕНИЙ МОРКОВИ ПРИ АГРОБАКТЕРИАЛЬНОЙ ТРАНСФОРМАЦИИ Пермякова Н.В., Дейнеко Е.В Вестник Томского государственного университета. Биология., 2015, № 4 (32) стр. 145-161 |
|
| Трансгенные растения как модели для изучения эпигенетической регуляции экспрессии генов Маренкова Т.В., Дейнеко Е.В. Vavilov journal of genetics and breeding, 2015, Т. 19. № 5. С. 545-551 |
|
| Бактериальные внутриклеточные патогены: стратегии нападения и защиты. Розов С.М., Дейнеко Е.В. Успехи современной биологии, 2015, т. 135, с. 464-479 |
|
| How cytomixis can form unreduced gametes in tobacco Sergey R. Mursalimov, Elena V. Deineko PLANT SYST EVOL, 2015, V 301 (4), pp 1293-1297 |
|
| Состояние исследований в области создания растительных вакцин ветеринарного назначения Пермякова Н.В., Уварова Е.А., Дейнеко Е.В. RUSS J PLANT PHYSL+, 2015, Т. 62, № 1, стр. 28-44 |
|
| Distribution of telomeres in the tobacco meiotic nuclei during cytomixis Sergey Mursalimov*, Yuri Sidorchuk, Sergey Baiborodin and Elena Deineko CELL BIOL INT, 2015, 39 (2015) 491–495 |
|
| Transgenic Carrot Expressing Fusion Protein Comprising M. tuberculosis Antigens Induces Immune Response in Mice Пермякова Наталья Владиславовна, Загорская Алла Алексеевна, Белавин Павел Александрович, Уварова Елена Александровна, Носарева Олеся Валерьевна, Нестеров Андрей Егорович, Новиковская Анна Алексеевна, Завьялов Евгений Леонидович, Мошкин Михаил Павлович, Дейнеко Елена Викторовна Biomed Res Int, 2015, Volume 2015 (2015), http://dx.doi.org/10.1155/2015/417565 |
|
| 2014 | Эффективность использования генов bmy2, waxy и внутренних транскрибируемых спейсеров генов рибосомных рнк в качестве маркеров для изучения генетического разнообразия видов рода Elymus. Шмаков Н.А., Афонников Д.А., Белавин П.А., Агафонов А.В. Vavilov journal of genetics and breeding, 2014, Т.18, № 4/2, С. 1022-1031 |
| Генетическая инженерия растений Дейнеко Елена Викторовна Vavilov journal of genetics and breeding, 2014, №1,Т.18, С.125-137. |
|
| Deformation of nuclei and abnormal spindles assembly in the second male meiosis of polyploid tobacco plants Yu.V. Sidorchuk and E.V. Deineko CELL BIOL INT, 2014, v.38, P.472-479 |
|
| 2013 | Ауксин: биосинтез, метаболизм, транспорт Розов С.М., Загорская А.А., Дейнеко Е.В., Шумный В.К. Успехи современной биологии, 2013, т. 133 с. 50-62 |
| Ауксин: регуляция и возможные пути ее модуляции Розов С.М., Загорская А.А., Дейнеко Е.В., Шумный В.К. Успехи современной биологии, 2013, т. 133 с. 115-123 |
|
| A New Series of Pea Symbiotic Mutants Induced in the Line SGE V. E. Tsyganov, V. A. Voroshilova, S. M. Rozov, A. Yu. Borisov, I. A. Tikhonovich Russian Journal of Genetics: Applied Research, 2013, v. 3, №2 p. 156–162. |
|
| Fine Localization of Locus Sym31 in Pea Linkage Group III V. E. Tsyganov, S. M. Rozov, M. Knox, A. Yu. Borisov, T. H. N. Ellis, I. A. Tikhonovich Russian Journal of Genetics: Applied Research, 2013, v. 3, №2 p. 114–119. |
|
| New insights into cytomixis: specific cellular features and prevalence in higher plants Mursalimov S., Sidorchuk Yu., Deineko E. PLANTA, 2013, V. 238(3) P. 415-423 |
|
| Auxins: Biosynthesis, Metabolism, and Transport Rozov S.M., Zagorskaya A.A., Deineko E.V., Shumny V.K. Biology Bulletin Reviews, 2013, v. 3, №4, p. 286-295 |
|
| Auxin: Regulation and Its Modulation Pathways Rozov S.M., Zagorskaya A.A., Deineko E.V., Shymny V.K. Biology Bulletin Reviews, 2013, v. 3. №6. p. 423-430 |
|
| MatrixCatch - a novel tool for the recognition of composite regulatory elements in promoters. BMC Igor V Deyneko, Alexander E Kel, Olga V Kel-Margoulis, Elena V Deineko, Edgar Wingender, Siegfried Weiss. BMC BIOINFORMATICS, 2013, 2013, 14:241. |
|
| Oral immunogenicity of plant-made ESAT6 or CFP10 Mycobacterium tuberculosis Уварова Елена Александровна Белавин Павел Александрович Пермякова Наталья Владиславовна Загорская Алла Алексеевна Носарева Олеся Валерьевна Кикимджанова Алмагуль Азизовна Дейнеко Елена Викторовна Biomed Res Int, 2013, Volume 2013 (2013), Article ID 316304, http://dx.doi.org/10.1155/2013/316304 |
|
| 2012 | Точная локализация локуса Sym31 в III группе сцепления гороха Цыганов В.Е., Розов С.М., Нокс М., Борисов А.Ю., Эллис Т.Г.Н., Тихонович И.А. Экологическая генетика, 2012, т. 10 с. 27-33 |
| Новая серия симбиотических мутантов гороха, индуцированных на линии SGE Цыганов В.Е., Ворошилова В.А., Розов С.М., Борисов А.Ю., Тихонович И.А. Экологическая генетика, 2012, т. 10 с. 19-26 |
|
| Выявление семейства NtFZY-генов табака Nicotiana tabacum, участвующих в триптофанзависимом пути биосинтеза ауксина Розов С.М., Загорская А.А., Щербаков Д.Н., Белавин П.А., Дейнеко Е.В., Шумный В.К. Doklady Akademii Nauk, 2012, т. 444 с. 101-104 |
|
| An ultrastructural study of microsporogenesis in tobacco line SR1 Mursalimov SR, Deineko EV BIOLOGIA, 2012, V. 67(2) P. 369-376 |
|
| АНАЛИЗ МОЗАИЧНОГО ПРОЯВЛЕНИЯ nptII-ГЕНА У КОНТРАСТНЫХ ПО МОЗАИЦИЗМУ ЛИНИЙ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА Д.Б. Логинова, П.Н. Меньшанов, Е.В. Дейнеко RUSS J GENET+, 2012, Т.48, №11, с.1280-1286 |
|
| Мозаичный характер экспрессии трансгенов у растений Маренкова Т.В., Логинова Д.Б., Дейнеко Е.В. RUSS J GENET+, 2012, том 48, №3, с. 293-306 |
|
| Рецензия на книгу Л.А. Лутовой, Т.А. Ежовой, И.Е. Додуевой и М.А. Осиповой “Генетика развития растений” Дейнеко Е.В., Шумный В.К. RUSS J GENET+, 2012, том 48, №6, с. 789 |
|
| Генетически модифицированные растения - продуценты рекомбинантных белков медицинского назначения Дейнеко Е.В. Вестник ТГУ, 2012, серия Биология, №2(18), с. 41-51 |
|
| Identification of the NtFZY gene family in Tobacco (Nicotiana tabacum) involved in the tryptophan-dependent auxin biosynthesis pathway. S. M. Rozov, A. A. Zagorskaya, D. N. Shcherbakov, P. A. Belavin, E. V. Deineko, V. K. Shumnyi Doklady Biochemistry and Biophysics, 2012, Volume 444. Number 1 (2012). P. 140-143. |
|
| The role of spherosome-like vesicles in formation of cytomictic channels between tobacco microsporocytes Mursalimov S., Sidorchuk Yu., Deineko E. BIOL PLANTARUM, 2012, V. 57(2) P. 291-297 |
|
| Transplastome plants Shchelkunov S.N., Konstantinov Yu.M., Deineko E.V. Russian Journal of Genetics: Applied Research, 2012, V. 2. No. 3. P. 270-276 |
|
| 2011 | Перспективы создания противотуберкулезных вакцин нового поколения Татьков С.И., Дейнеко Е.В., Фурман Д.П. Vavilov journal of genetics and breeding, 2011, т. 15, №1. с. 114-129. |
| Спонтанные мутации в гене rrn16 хлоропластного генома, обуславливающие устойчивость к спектиномицину, у каллусных линий Daucus carota. Е. А. Филипенко, Ю. В. Сидорчук, Е. В. Дейнеко RUSS J GENET+, 2011, № 1, т.47, с.41-47 |
|
| Spontaneous spectinomycin resistance mutations detected after biolistic transformation of Daucus carota L. Elena A. Filipenko, Yuri V. Sidorchuk, Igor I. Titov, Valery P. Maltsev and Elena V. Deineko PHYSIOL MOL PLANT P, 2011, Volume 17, Number 1, 79-86 |
|
| An ultrastructural study of cytomixis in tobacco pollen mother cells Mursalimov S.R., Deineko E.V. PROTOPLASMA, 2011, V. 248, N 4, P. 717-724. |
|
| Перспективы создания вакцин на основе генетически модифицированных растений Дейнеко Е.В., Ткачев С.Е. Инфекции, передаваемые клещами в Сибирском регионе, Интеграционные проекты. СО РАН, 2011, Выпуск 30. Глава 6. С.174-182 |
|
| Prospects for Designing New Generation Anti-Tuberculosis Vaccines S.I. Tat’kov, E.V. Deineko, D.P. Furman Russian Journal of Genetics: Applied Research, 2011, 2011, Vol. 1, No. 4, pp. 290–301 |
|
| Транспластомные растения Щелкунов С.Н., Констанитнов Ю.М., Дейнеко Е.В. Vavilov journal of genetics and breeding, 2011, том 15, №4, с. 808-817 |
|
| The Coch gene controls the subsequent differentiation of pea axial meristems into lateral structures. Rozov, S.M., Voroshilova, V.A., Tsyganov, V.E., Priefer, U.B., Borisov, A.Y. and Tikhonovish, I.A. Pisum Genetics, 2011, v. 43, p. 5-11 |
|
| The new xantha-variegata-viredescens mutation in pea — xavs Rozov S.M. Pisum Genetics, 2011, v. 43, p 11-13 |
|
| 2010 | Использование молекулярных маркеров в селекции рапса на содержание и качество масла Денисова Э.В. Научное обеспечение отрасли рапсосеяния и пути реализации биологического потенциала рапса. Липецк: "Типография", 2010, С. 39-63. |
| Особенности организации Т-ДНК-встройки у трансгенных растений табака линии Nu 21 Логинова Д.Б., В.К. Шумный, Е.В. Дейнеко Информационный вестник ВОГИС, 2010, Т. 14. - №1. - С. 659- 665. |
|
| Особенности формирования цитомиктических каналов в материнских клетках пыльцы Nicotiana tabacum L Мурсалимов С.Р., Байбородин С.И., Сидорчук Ю.В., Шумный В.К., Дейнеко Е.В. CYTOL GENET+, 2010, Т. 44. №1. С. 19-24 |
|
| Современные молекулярные технологии и их использование в селекции Денисова Э.В. Научное обеспечение отрасли рапсосеяния и пути реализации биологического потенциала рапса. Липецк: "Типография", 2010, С. 63-75 |
|
| тетраплоидная рожь: увеличение числа ростовых пор в пыльце Попова И.С. Сибирский вестник сельскохозяйственной науки, 2010, № 2. - С. - 21-27 |
|
| Тетраплоидная рожь: эндогенная изменчивость псевдосовместимости Попова И.С., Шумный В.К. Информационный вестник ВОГИС, 2010, Т. 14. - № 1. С. - 155 - 164 |
|
| Трансформация митохондрий табака генетической конструкцией с интегративными свойствами и отбор клеточных линий с трансгенными митохондриями по устойчивости к антимицину А. Катышев А.И., Шмаков В.Н., Черникова В.В., Сидорчук Ю.В., Дейнеко Е.В., Константинов Ю.М. Известия Иркутского государственного университета. Серия «Биология. Экология», 2010, №3. С.13-19 |
|
| Rational design based synthetic polyepitope DNA vaccine for eliciting HIV-specific CD8+T cell responses Bazhan SI, Karpenko LI, Ilyicheva TN, Belavin PA, Seregin SV, Danilyuk NK, Antonets DV, Ilyichev AA MOL IMMUNOL, 2010, volume: 47 Issue: 7-8 Pages: 1507-1515 |
|
| Инактивирование генов у растений на уровне транскрипции Маренкова Т.В., Дейнеко Е.В. RUSS J GENET+, 2010, № 5, том 46, с. 511-520 |
|
| Хаотизация веретена деления фрагмопласта и телофазных групп хромосом в мейозе у пшенично-пырейных гибридов первого поколения Шамина Н.В., Илющенкова Н.С., Пыльник Т.О., Соловьева М.Ю., Спицина Ю.Е. Цитология, 2010 |
|
| 2009 | К вопросу об использовании цитологических признаков при мониторинге окружающей среды Попова И.С. Вiсник Украiнського товариства генетикiв i селекцiонерiв, 2009, Т. 7, № 2, С. 242 - 248 |
| Особенности варьирования композиции жирных кислот у жёлтосемянных генотипов ярового рапса (Brassica napus L.) Денисова Э.В., Мазяркина Т.В. Аграрная наука, 2009, № 11, с.10-13., 2009 |
|
| Особенности районов встраивания Т-ДНК у трансгенных растений Филипенко Е.А., Дейнеко Е.В., Шумный В.К. RUSS J GENET+, 2009, №11, том 45. С.1477-1491. |
|
| Сравнительный анализ иммуногенности трансгенной моркови, продуцирующей S или M антигены вируса гепатита В при оральной иммунизации мышей Щелкунов С.Н., Нестеров А.Е., С.Г.Поздняков, Г.А.Щелкунова, А.А.Загорская, Е.А.Филипенко, Н.В.Пермякова, Л.Д.Позднякова, В.В.Власов, В.К.Шумный, Е.В.Дейнеко Российский иммунологический журнал, 2009, Т. 3(12), № 3-4. С. 235-245 |
|
| Феноменология псевдосовместимости у яровой диплоидной ржи из коллекции ВИР Попова И.С. Труды по прикладной ботанике, генетике и селекции, 2009, Т. 166. - С 457 - 463. |
|
| Design of Artificial Polyepitope DNA Vaccine Constructs for Eliciting of HIV-Specific CD8+CTL Responses Oreshkova S, Bazhan S, Belavin P, Ilyicheva T, Seregin S, Ilyichev A , Karpenko L ANTIVIR RES, 2009, Volume: 82 Issue: 2 Pages: A25-A25 |
|
| Цитомиксис в образцах из природных популяций DACTYLIS GLOMERATA L. (POACEAE) Мурсалимов С.Р., Дейнеко Е.В. Информационный вестник ВОГИС, 2009, №4, Т.13, С. 772-777 |
|
| Эндогенная изменчивость частоты аномальных тетрад в мейозе микроспорогенеза у тетраплоидной ржи Попова И.С.. Кузнецова Т.Ю. Сибирский вестник сельскохозяйственной науки, 2009, № 9, С. - 13-18 |
|
| Использование методов генетической инженерии в селекции овощных культур. Дейнеко Е.В. Сборник научных трудов "Овощеводство в Сибири", Новосибирск, 2009, С.210-220 |
|
| Рабочая программа дисциплины - Генетическая инженерия растений - для студентов 5 курса Дейнеко Е.В. Учебно-методическая разработка, 2009, Томск, Томский госуниверситет |
|
| Генетическая инженерия растений Дейнеко Е.В. Учебнометодическая разработка, 2009, Томск, Томский госуниверситет, 2009 |
|
| Агробактериальная трансформация растений: перенос фрагментов векторной ДНК в растительный геном Пермякова Н.В., Шумный В.К., Дейнеко Е.В. RUSS J GENET+, 2009, №3, том 45. С.305-317 |
|
| Анализ продукции М-антигена вируса гепатита В в листьях трансгенных растений моркови Дейнеко Е.В., Загорская А.А., Поздняков С.Г., Филипенко Е.А., Пермякова Н.В., Сидорчук Ю.В., Уварова Е.А., Позднякова Л.Д., Шумный В.К., Власов В.В., Хэммонд Р.В., Щелкунов С.Н. Doklady Akademii Nauk, 2009, №3, том 425. С.400-403 |
|
| Динамика ИУК и цитокининов в тканях цветков трансгенных растений табака с мутантным фенотипом Загорская А.А., Сидорчук Ю.В., Шумный В.К., Дейнеко Е.В. Физиология растений, 2009, Т. 56. №6. С. 917–925. |
|
| 2008 | Использование трансгенных растений моркови-продуцентов интерлейкина-18 человека для модуляции иммунных реакций у мышей Якушенко Е.В., Лопатникова Ю.А., Сенников С.В., Шаталина М.Н., Филипенко Е.А., Дейнеко Е.В., Воронина Е.Н., Храпов Е.А., Филипенко М.Л., Шумный В.К., Козлов В.А. Бюллетень СО РАМН, 2008, №3(131) С.70-75 |
| Преждевременный цитокинез в материнских клетках пыльцы трансгенных растений табака (Nicotiana tabacum L.) Сидорчук Ю.В., Дорогова Н.В., Дейнеко Е.В., Шумный В.К. Cell and Tissue Biology, 2008, Т. 50. № 5. С.447-451. |
|
| Тетраплоидная рожь: динамика псевдосовместимости Попова И.С., Шумный В.К. Информационный вестник ВОГИС, 2008, №3, том 12, С. 378-384 |
|
| Вариабельность признаков, определяющих биохимические качества семян в инбредных популяциях ярового рапса типа 000 Денисова Э.В. Сибирский вестник сельскохозяйственной науки, 2008, № 2. С. 40-47 |
|
| 2007 | Кортикальное цитоскелетное кольцо в профазе II приводит к коррекции аномалий первого мейотического деления и к реституции ядер в материнских клетках пыльцы. Н.В. Шамина, Ю.Р. Максютова, И.А. Запорожченко, О.А.Шацкая. Cell and Tissue Biology, 2007, т. 49, №10, стр. 865-869. |
| Особенности встраивания векторных последовательностей в геном трансгенных растений Пермякова Н.В., Дейнеко Е.В., Шумный В.К. RUSS J GENET+, 2007, Т.43. № 11. С.1501-1510 |
|
| Особенности цитомиксиса в материнских клетках пыльцы у трансгенных растений табака (Nicotiana tabacum L.) с мутантным фенотипом Сидорчук Ю.В., Дейнеко Е.В., Шумный В.К. Cell and Tissue Biology, 2007, Т.49,№10, С.870-875 |
|
| Пути улучшения питательной ценности рапсового шрота Мазяркина Т.В. Денисова Э.В. Аграрная наука, 2007, №7, С. 8-12 |
|
| Роль микротрубочкового цитоскелета и каллозных оболочек в проявлении цитомиксиса в материнских клетках пыльцы растений табака (Nicotiana tabacum L.) Сидорчук Ю.В., Дейнеко Е.В., Шумный В.К. Cell and Tissue Biology, 2007, Т. 49. № 10. С. 876-880. |
|
| Т-ДНК индуцированные мутации у трансгенных растений Дейнеко Е.В., Загорская А.А., Шумный В.К. RUSS J GENET+, 2007, №1, т.43, с.5-17 |
|
| Formation and function of phragmoplast during successive cytokinesis stages in higher plant meiosis Shamina N.V., Gordeeva E.I., Kovaleva N.M., Seriukova E.G., Dorogova N.V. CELL BIOL INT, 2007, v.31, pp 626-635 |
|
| Mosaic expression pattern of the nptII gene in transgenic tobacco plants Nu21 Marenkova T.V., Deineko E.V., ShumnyV.K. RUSS J GENET+, 2007, №7,V43, pp780-790 |
|
| Мозаичный характер проявления гена nptII у трансгенных растений табака линии Nu21 Маренкова Т.В., Дейнеко Е.В., Шумный В.К. RUSS J GENET+, 2007, Том 43, №1, С.943-954 |
|
| Regulatory genes of garden pea (Pisum sativum L.) controlling the development of nitrogen-fixing nodules and arbuscular mycorrhiza: A review of basic and applied aspects. Borisov A. Yu., Danilova T. N., Koroleva T. A., Kuznetsova, E. V., Madsen L., Mofett M., Naumkina T. S., Nemankin T. A., Ovchinnikova E. S., Pavlova Z. B., Petrova N. E., Pinaev A. G., Radutoiu S., Rozov S. M., Rychagova T. S., Shtark O. Yu., Solovov APPL BIOCHEM MICRO+, 2007, v.43 N3, p. 237-243, 2007 |
|
| Природа Академгородка в исследованиях роли генов гистона H1 в макро- и микроэволюции. Костерин О.Э., Богданова В.С., Розов С.М. Природа Академгородка: 50 лет спустя. отв. ред. И.Ф. Жимулев; Рос. акад. наук, Сиб. отд-ние, Ин-т цитологии и генетики [и др.]. - Новосибирск: Издательство СО РАН, 2007. - 250 с., 2007 |
|
| Genome synteny of Pea and model Legumes: From mutation through genetic mapping to the genes. V. A. Zhukov, A. Y. Borisov, E. V. Kuznetsova, L. H. Madsen, M. D. Moffet, E. S. Ovchinnikova, A. G. Pinaev, S. Radutoiu, S. M. Rozov, T. S. Rychagova, O. Y. Shtark, V. E. Tsyganov, V. A. Voroshilova, J. Stougaard, N. F. Weeden and I. A. Tikhonovich. Current Plant Science and Biotechnology in Agriculture, 2007 |
|
| Анализ сайтов встраивания Т-ДНК инсерций у трансгенных растений табака Филипенко Е.А., Филипенко М.Л., Дейнеко Е.В., Шумный В.К. CYTOL GENET+, 2007, №4, т.41, с.3-8, 2007 |
|
| Арест хромосом в "букете" и его последствия для асинаптического мейоза у злаков – гаплоидов и отдаленных гибридов первого поколения Н.В. Шамина, Ж.М. Мухина, Е.И. Гордеева, П.С. Орлов Cell and Tissue Biology, 2007, т. 49, №8, стр. 690-695 |
|
| 2006 | Многополюсные веретена в мейозе у высших растений Шамина Н.В., Шацкая О.А., Соловьева Н.В., Блинова Е.А. Cell and Tissue Biology, 2006, 48 (2): 114-119 |
| О возможностях повышения эффективности селекции ярового рапса на улучшение технологических качеств семян Мазяркина Т.В., Денисова Э.В. Сельскохозяйственная биология, 2006, № 5. С. 34-40. |
|
| Улучшение качества рапсового масла по составу жирных кислот Мазяркина Т.В., Денисова Э.В. Кормопроизводство, 2006, №10, С. 26-29 |
|
| Use of Transgenic Carrot Plants Producing Human Interleukin-18 for Modulation of Mous Immune Reactions Якушенко У.В., Храпов Ю.А., Дейнеко Е.В., Воронина Е.Н., Филипенко М.Л., Шумный В.К., Сенников Ы.В., Козлов В.А. In Book: New research on Biotechnology and Medicine. Eds.: Egorov A.M., Zaikov G.E. Nova Science Publishers, 2006, P.97-107 |
|
| Биотехнология и генная инженерия растений. Карначук Р.А., Гвоздева Е.С., Дейнеко Е.В., Шумный В.К. Учебное пособие, 2006, Томск, Томский госуниверситет, ИД "СКК-Пресс" |
|
| A new allele at the Tl locus — tlna. Pisum Genetics, 2006, 38, pp. 15–16. Rozov SM Pisum Genetics, 2006 |
|
| Two new pea mutations simultaneously affecting tendrils and leaflet shape and plant internode length. Rozov SM Pisum Genetics, 2006 |
|
| Symbiotic gene sym33 is located on linkage group I. Tsyganov V.E., Rozov S.M., Borisov A.Y., Tikhonovitch I.A. Pisum Genetics, 2006 |
|
| A new dominant-acting necrosis mutation in pea. Rozov SM Pisum Genetics, 2006 |
|
| New mutation in pea affecting tendrils (taa): lateral tendrils grow at an acute angle. Rozov SM Pisum Genetics, 2006 |
|
| The effect of duplications in the T-DNA on the stability of manifestation of heterologous genes in transgenic tobacco plants Marenkova T.V., Deineko E.V. RUSS J GENET+, 2006, №5,V42, pp526-531 |
|
| Диагностикум аномалий растительного мейоза по его продуктам Н.В. Шамина Cell and Tissue Biology, 2006, 48 (6): 486-494 |
|
| Динамика микротрубочкового цитоскелета в мейозе у высших растений. IX. Завершение цикла. Переход от фрагмопласта к интерфазной системе цитоскелета Н.В. Шамина, Ю.В. Сидорчук, Н.В. Дорогова Cell and Tissue Biology, 2006, т. 48, №5, с. 418-426 |
|
| Динамика микротрубочкового цитоскелета в мейозе у высших растений. VII. Процессы одновременного (симультанного) цитокинеза Н.В. Шамина, Н.В. Дорогова Cell and Tissue Biology, 2006, V. 48. № 2, С. 127-132. |
|
| Динамика микротрубочкового цитоскелета в мейозе у высших растений. VIII. Последовательный и одновременный цитокинез в сравнении Шамина Н.В., Е. И. Гордеева, Е.И. Серюкова. Cell and Tissue Biology, 2006, 48 (3): 220-225 |
|
| Динамика микротрубочкового цитоскелета в мейозе у высших растений. Х. Общая схема цитоскелетного цикла Шамина Н.В., Сидорчук Ю.В. Cell and Tissue Biology, 2006, т. 48, №5, с. 427-437 |
|
| A change in the stability of marker nptII and uidA gene expression in transgenic tobacco plants Marenkova T.V., Deineko E.V. RUSS J GENET+, 2006, №5,V42, pp518-525 |
|
| Изменения в ориентации фрагмопласта в результате его чрезмерного центробежного движения при отсутствии клеточной пластинки Шамина Н.В., Ковалева Н.М., Шацкая О.А. Cell and Tissue Biology, 2006, 48 (12): 1023-1029 |
|
| 2005 | Создание клонотек фрагментов ДНК полных геномов разных штаммов вируса натуральной оспы Сафронов П.Ф., Щелкунов С.Н., Тотменин А.В., Голикова Л.Н., Бабкина И.Н., Бабкин И.В., Гуськов А.А., Михеев М.В., Сокунова Е.Б., Серегина Е.В., Уварова Е.А. Вопросы вирусологии, 2005, N 2.-С.18-23 |
| The gene of the complement-binding protein, an important anti-inflammatory factor of orthopoxviruses, is deleted from the genome of Western African strains of monkeypox virus. E A Uvarova; A V Totmenin; L S Sandakhchiev; S N Shchelkunov Doklady Biochemistry and Biophysics, 2005, Jan-Feb;400:14-6. |
|
| 2002 | Analysis of the monkeypox virus genome. Shchelkunov SN, Totmenin AV, Safronov PF, Mikheev MV, Gutorov VV, Ryazankina OI, Petrov NA, Babkin IV, Uvarova EA, Sandakhchiev LS, Sisler JR, Esposito JJ, Damon IK, Jahrling PB, Moss B. VIROLOGY, 2002, Jun 5;297(2):172-94. |
| Множественные генетические различия между вирусами натуральной оспы и оспы обезьян. Щелкунов C.H., Тотменин A.B., Сафронов П.Ф., Гуторов В.В., Рязанкина О.И., Петров Н.А., Бабкин И.В., Уварова Е.А., Михеев М.В., Сислер Дж., Эспозито Дж, Ярлинг П., Мосс Б. Doklady Akademii Nauk, 2002, Т. 384. № 1. С. 126-130. |
|
| 2001 | Species-specific differences in the structure of orthopoxvirus complement-binding protein. Uvarova EA, Shchelkunov SN. VIRUS RES, 2001, Dec 4;81(1-2):39-45. |
| Human monkeypox and smallpox viruses: genomic comparison. Shchelkunov SN, Totmenin AV, Babkin IV, Safronov PF, Ryazankina OI, Petrov NA, Gutorov VV, Uvarova EA, Mikheev MV, Sisler JR, Esposito JJ, Jahrling PB, Moss B, Sandakhchiev LS. FEBS LETT, 2001, Nov 30;509(1):66-70 |
|
| Видоспецифичные различия в организации комплементсвязывающего белка ортопоксвирусов. Щелкунов С.Н., Уварова Е.А., Тотменин А.В., Сафронов П.Ф., Сандахчиев Л.C Doklady Akademii Nauk, 2001, Т. 379, № 4, С. 553-557 |
|
| 1997 | Экспрессия фрагментов гена Е вируса японского энцефалита в клетках Escherichia coli Белавин П.А., Нетесова Н.А., Решетников С.С., Иванисенко В.А., Ерошкин А.М., Протопопова Е.В., Локтев В.Б., Малыгин Э.Г. Биотехнология, 1997, N.3, С.3-10 |
 Монографии
Монографии
| 2011 | Концепции современного естествознания Розов СМ |
 Конференции
Конференции
| 2019 | Studying of the molecular-genetic control of polyphenolic pigmentation in wheat and barley as a basis for breeding antioxidant-rich cereals Shoeva O.Yu., Gordeeva E.I., Kukoeva T.V., Strygina K.V., Vikhorev A.V., Glagoleva A.Yu., Shmakov N.A., Levanova N.M., Mursalimov S.R., Yudina R.S., Börner А., Khlestkina E.K. VII съезд Вавиловского общества генетиков и селекционеров, посвященный 100-летию кафедры генетики СПбГУ, и ассоциированные симпозиумы |
| Выявление генов-кандидатов локуса Blp, контролирующего формирование признака чёрной окраски колоса ячменя (Hordeum vulgare l.) Глаголева А.Ю., Шмаков Н.А., Мурсалимов С.Р., Хлесткина Е.К., Шоева О.Ю. VII съезд Вавиловского общества генетиков и селекционеров, посвященный 100-летию кафедры генетики СПбГУ, и ассоциированные симпозиумы |
|
| 2018 | Analysis of relationships between putative genetic markers and immune response in patients with uterine myoma Volkova O., Kondrakhin Yu., Sharipov R., Prokofev V., Shevchenko A., Konenkov V. Systems Biology and Biomedicine (SBioMed-2018): Symposium |
| 2017 | Биосинтез рекомбинантных белков в культурах клеток высших растений Сидорчук Ю.В., Загорская А.А., Дейнеко Е.В. Годичное собрание Общества физиологов растений России. Научная конференция и школа молодых ученых: «ЭКСПЕРИМЕНТАЛЬНАЯ БИОЛОГИЯ РАСТЕНИЙ: ФУНДАМЕНТАЛЬНЫЕ И ПРИКЛАДНЫЕ АСПЕКТЫ» |
| 2016 | Регуляторные элементы для тканеспецифичной экспрессии трансгенов в растениях. Сидорчук Ю.В., Кузнецов В.В., Маренкова Т.В., Герасименко И.М., Шелудько Ю.В., Дейнеко Е.В. VI Всероссийский симпозиум "Трансгенные растения:технологии создания, биологические свойства, применение, биобезопасность" |
| Трансгенные растения как продуценты химерного рекомбинантного CFP10-ESAT6-dIFN-белка против Mycobacterium tuberculosis. Белавин П.А., Уфимцева Е.Г., Уварова Е.А., Мурсалимов С.Р., Сидорчук Ю.В., Розов С.М., Пермякова Н.В., Загорская А.А., Маренкова Т.В., Банникова С.В., Демидов Е.А., Старостин К.В., Кравченко М.А., Вахрушева Д.В., Бердников Р.Б., Еремеева Н.И., Скорняков С.Н., Пельтек С.Е., Дейнеко Е.В. VI Всероссийский симпозиум "Трансгенные растения:технологии создания, биологические свойства, применение, биобезопасность" |
|
| Конкурентное и кооперативное поведение клеток в микроспорогенезе покрытосеменных Кравец Е.А., Плоховская С.Г., Горюнова И.И., Сидорчук Ю.В., Мурсалимов С.Р., Дейнеко Е.В., Емец А.И., Блюм Я.Б. XI Международная конференция «Факторы экспериментальной эволюции организмов» |
|
| Influence of a lignification and mineralization of leaf tissues on resistance of bread wheat plants to a brown rust. Konovalov A.A., Shundrina I.K., Karpova E.V., Orlova E.A., Goncharov N.P. Plant Genetics and Genomics for Food Security. The 1st International Workshop. |
|
| Cytomixis do not trigger chromatin modifications and programmed cell death in tobacco male meiocytes Sergey Mursalimov, Natalya Permyakova, Elena Deineko, Andreas Houben, Dmitri Demidov Epigenetic and Chromatin Regulation of Plant Traits |
|
| Cytomixis in Tobacco Microsporogenesis: Are There Genome Parts Predetermined to Migration? Sergey Mursalimov, Elena Deineko 12th International Congress of Cell Biology |
|
| Использование суспензий растительных клеток для наработки рекомбинантных белков медицинского назначения Загорская А.А., Сидорчук Ю.В., Дейнеко Е.В. VI Всероссийский симпозиум "Трансгенные растения:технологии создания, биологические свойства, применение, биобезопасность" |
|
| 2015 | Регуляторные элементы для тканеспецифичной экспрессии трансгенов в растениях Сидорчук Ю.В., Герасименко И.М., Шелудько Ю.В., Дейнеко Е.В. VIII Съезд общества физиологов растений России. Растения в условиях глобальных и локальных природно-климатических и антропологических воздействий. |
| Межклеточные контакты у растений: новый взгляд на цитомиксис Мурсалимов С.Р., Сидорчук Ю.В., Дейнеко Е.В. VIII Съезд общества физиологов растений России. Растения в условиях глобальных и локальных природно-климатических и антропологических воздействий. |
|
| Histone modifications during cytomixis in tobacco Sergey Mursalimov, Dmitri Demidov, Natalya Permyakova, Elena Deineko, Andreas Houben 10th European Cytogenetics Conference 2015 |
|
| What kind of chromatin migrates between cells during cytomixis? Sergey Mursalimov, Sidorchuk Yuri, Natalya Permyakova, Dmitri Demidov, Andreas Houben, Elena Deineko Chromosome 2015 |
|
| 2014 | Характеристика регуляторных элементов для экспрессии трансгенов в меристемах растений Сидорчук Ю.В., Герасименко И.М., Казанцев А.А., Шелудько Ю.В., Дейнеко Е.В. V Всероссийский симпозиум «Трансгенные растения: технологии создания, биологические свойства, применение, биобезопасность», |
| Cytomixis: specific cellular features and prevalence in higher plants Mursalimov S.R., Sidorchuk Yu.V., Deineko E.V. 23rd International Congress on Sexual Plant Reproduction |
|
| Force-induced globule-coil transition in Laminin Binding Protein and its role for viral – cell membrane fusion Zaitsev B. N., Benedetti F., Mikhaylov A. G. Korneev D. V., Sekatskii S. K., Belavin P. A., Protopopova E. V., Dietler G., Loktev V. B. XVIth International Congress of Virology |
|
| ТРАНСГЕННЫЕ РАСТЕНИЯ – ПРОДУЦЕНТЫ СУБЪЕДИНИЧНЫХ КАНДИДАТНЫХ СЪЕДОБНЫХ ВАКЦИН Дейнеко Е.В. Международная научная конференция и школа молодых ученых «Физиология растений- теоретическая основа инновационных агро- и фитобиотехнологий», |
|
| Разработка «съедобных вакцин» на основе генетически модифицированных растений. Дейнеко Елена Викторовна "Биотехнология: от бактериофагов до вакцин" |
|
| Cтабильность экспрессии и наследование чужеродных генов у трансгенных растений Дейнеко Елена Викторовна, Маренкова Татьяна Владиславовна «Трансгенные растения: технологии создания, биологические свойства, применение, биобезопасность» |
|
| ТРАНСГЕННЫЕ РАСТЕНИЯ – ПРОДУЦЕНТЫ ФАРМАЦЕВТИЧЕСКИ-ЦЕННЫХ БЕЛКОВ Дейнеко Елена Викторовна «ГМО: история, достижения, социальные и экологические риски» |
|
| «Гибридологический анализ взаимодействия эпигенетических аллелей у трансгенных растений». Маренкова Татьяна Владиславовна, Дейнеко Елена Викторовна V Всероссийский симпозиум «Трансгенные растения: технологии создания, биологические свойства, применение, биобезопасность», |
|
| 2013 | Клонирование и характеристика регуляторных элементов для экспрессии трансгенов в меристемах растений Сидорчук Ю.В., Герасименко И.М., Казанцев А.А., Шелудько Ю.В., Дейнеко Е.В. Х Международная конференция "Биология клеток растений in vitro и биотехнология |
| Cомаклональная изменчивость в культуре клеток табака, как источник уникальных моделей для цитологических исследований Мурсалимов С.Р., Сидорчук Ю.В., Дейнеко Е.В. X Международная конференция «Биология клеток растений in vitro и биотехнология» |
|
| ТРАНСГЕННЫЕ РАСТЕНИЯ – БИОПРОДУЦЕНТЫ ФАРМАЦЕВТИЧЕСКИ-ЦЕННЫХ БЕЛКОВ Дейнеко Елена Викторовна Х Международная конференция "Биология клеток растений in vitro и биотехнология" |
|
| Стабильность экспрессии и наследование чужеродных генов у трансгенных растений Маренкова Татьяна Владиславовна Дейнеко Елена Викторовна "Новые технологии для новой экономики России" -VIII Петербургская встреча лауреатов Нобелевской премии. |
|
| Характеристика регуляторных элементов для экспрессии трансгенов в меристемах растений Сидорчук Ю.В., Герасименко И.М., Казанцев А.А., Шелудько Ю.В., Дейнеко Е.В. VIII Международная научная конференция «Факторы экспериментальной эволюции организмов» |
|
| Сравнительный анализ иммуногенности трансгенных растений моркови, продуцирующих антигены Mycobacterium tuberculosis, при пероральной иммунизации мышей. Е.В.Дейнеко , Н.В.Пермякова, Е.А.Уварова, А.А.Загорская, П.А.Белавин, О.В.Носарева, А.Е.Нестеров, Е.Л.Завьялов, М.П.Мошкин III ЕЖЕГОДНАЯ КОНФЕРЕНЦИЯ СПЕЦИАЛИСТОВ ПО РАБОТЕ С ЛАБОРАТОРНЫМИ ЖИВОТНЫМИ (Rus-LASA) |
|
| Генетическая инженерия растений Дейнеко Елена Викторовна ВОГИС |
|
| The study of the dynamics of IAA and identify FZY-genes in transgenic tobacco plants. Zagorskaya A.A., Rozov S.M., Deineko E.V. The X International conference “Plant cell biology in vitro and biotechnology” |
|
| 2012 | Создание клеточной линии с высокой эффективностью синтеза рекомбинантного белка в условиях суспензионной культуры Загорская А.А., Сидорчук Ю.В., Дейнеко Е.В. Биология – наука XXI века |
| Light and electron microscopic study of cytomixis in tobacco lines with different ploidy levels Mursalimov SR, Deineko EV 11th Gatersleben Research Conference CHROMOSOME BIOLOGY, GENOME EVOLUTION AND SPECIATION |
|
| The action of brassinolide and jasmonic acid on skotomorphogenesis of transgenic tobacco plants (Nicotiana tabacum L.) Gvozdeva Elena, Deineko Elena Plant Biology Congress |
|
| Генетически-модифицированные растения - продуценты рекомбинантных белков медицинского назнаения. Дейнеко Елена Викторовна IV Всероссийский симпозиум ТРАНСГЕННЫЕ РАСТЕНИЯ: технологии создания, биологические свойства, применением, биобезопасность. |
|
| ОСОБЕННОСТИ СКОТОМОРФОГЕНЕЗА ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА (Nicotiana tabacum L.) ПОД ДЕЙСТВИЕМ ВЕРАПАМИЛА Гвоздева Е.С., Дейнеко Е.В. IV Всероссийский симпозиум ТРАНСГЕННЫЕ РАСТЕНИЯ: технологии создания, биологические свойства, применение, биобезопасность. |
|
| ВЗАИМОДЕЙСТВИЕ АЛЛЕЛЕЙ ГЕНА nptII У ГИБРИДОВ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА Логингова Д.Б., Дейнеко Е.В. IV Всероссийский симпозиум ТРАНСГЕННЫЕ РАСТЕНИЯ: технологии создания, биологические свойства, применение, биобезопасность. |
|
| Создание трансгенных растений - биореакторов для наработки фармакологически ценных белков Дейнеко Е.В. III международная научно-практическая конференция "Постгеномные методы анализа в биологии, лабораторной и клинической медицине" |
|
| ИЗМЕНЕНИЕ МОРФОЛОГИИ ЦВЕТКА И ДИНАМИКА ИУК У ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА Загорская А.А., Розов С.М., Дейнеко Е.В. IV Всероссийский симпозиум "ТРАНСГЕННЫЕ РАСТЕНИЯ: технология создания, биологические свойства, применение, биобезопасность" |
|
| Внеядерные геномы растений как перспективные системы экспрессии рекомбинантных белков СИДОРЧУК Ю.В., ЗАГОРСКАЯ А.А., УВАРОВА Е.А., ДЕЙНЕКО Е.В. «Биология – наука XXI века» |
|
| Cytomixis and nuclear vacuoles in tobacco microsporogenesis Mursalimov SR, Deineko EV The International PhD Student Conference on Experimental Plant Biology |
|
| 2011 | Subcelluar aspects of cytomixis in microsporogenesis of transgenetic mutant tobacco plants Mursalimov S.R., Deineko E.V. VII International Scientific Conference for Students and PhD Students "YOUTH AND PROGRESS OF BIOLOGY" |
| Влияние уровня плоидности на частоту цитомиксиса в микроспорогенезе табака Мурсалимов С.Р., Сидорчук Ю.В., Дейнеко Е.В. VІІ Международная научная конференция "Факторы экспериментальной эволюции организмов" |
|
| Формирование веретена деления в мейозе пшенично-ржаных полигаплоидов Сидорчук Ю.В., Силкова О.Г. VII международная конференция «Факторы экспериментальной эволюции организмов». |
|
| Изучение особенностей микроспорогенеза трансгенных растений табака Мурсалимов С.Р., Дейнеко Е.В. 2-ая Международная школа-конференция «Генетика и селекция растений, основанная на современных генетических знаниях и технологиях» |
|
| Comparison of molecular composition of pericentric heterochromatin of two grasshopper species from Gomphocerini tribe (Acrididae; Orthoptera) Jetybayev I.E., Bugrov A.G., Belavin P.A., Tatkov S.I., Shvalov A.N. Rubtsov N.B 18th International Chromosome Conference |
|
| 2010 | Ультраструктурные особенности цитомиксиса как нормального клеточного процесса в ходе микроспорогенеза табака Мурсалимов С.Р., Дейнеко Е.В. 1 Всероссийская МНК "Фундаментальные и прикладные аспекты современной биологии", Томск, 6-9 октября 2010 |
| Development of novel carrot plant-based oral vaccine against hepatitis B. Uvarova EA, Deineko EV, Shchelkunov SN 7th International conference on bioinformatics of genome regulation and structure\system biology (BGRS/SB'20010). June 20-27, 2010, Novosibirsk |
|
| Фотоморфология трансгенных растений на примере табака Гвоздева Е.С., Дейнеко Е.В., Карначук Р.А. III Всероссийский симпозиум "Физиология трансгенного растения и проблемы биобезопасности". Москва, 18 - 21 октября |
|
| Анализ спектиномицин-устойчивых каллусных линий моркови (Daucus carota), выделенных при хлоропластной трансформации Филипенко Е.А., Сидорчук Ю.В., Загорская А.А., Жариков Т.Ю., Дейнеко Е.В. VI Международная конференция "Факторы экспериментальной эволюции", Украина,г. Алушта, 21-25 сентября |
|
| Технологии создания трансгенных растений для решения фундаментальных и прикладных задач Дейнеко Е.В., Брускин С.С., Пирузян Э.С., Шумный В.К. Совместный пленум Научного Совета по генетике и селекции РАН и Центрального Совета ВОГиС. Москва, 10 ноября 2010 г. |
|
| 2009 | Трансгенные растения в качестве моделей для фундаментальных исследований функционирования генов (на примере N.tabacum L.) Дейнеко Е.В., Маренкова Т.В., Логинова Д.Б., Филипенко Е.А., Загорская А.А., Сидорчук Ю.В., Шумный В.К. 5-й съезд ВОГИС, посвященный 200-летию со дня рождения Чарльза Дарвина, Москва, 21-28 июня 2009 г. |
| Участие сферосом в формировании цитомиктических каналов Мурсалимов С.Р. IV Международная конференция молодых учёных "Биология: от молекулы до биосферы", Харьков, Украина |
|
| Development of novel carrot plant-based oral vaccine against hepatitis B. Deineko E.V. Russian-German Simposium. Novosibirsk. Russia. 2009. |
|
| Динамика фитогормонов и формирование мутантного фенотипа у трансгенных растений табака Сидорчук Ю.В., Загорская А.А., Дейнеко Е.В. V Международная научная конференция "Факторы экспериментальной эволюции организмов" г. Алушта (Автономная Республика Крым, Украина) 21-25 сентября |
|
| Межклеточные контакты в материнских клетках пыльцы у трансгенных растений табака Мурсалимов С.Р., Сидорчук Ю.В., Дейнеко Е.В. VII Международная школа-конференция "Молекулярная генетика соматических клеток", 22-25 октября 2009, Звенигород (Москва) |
|
| Поведение клеточных органелл при цитомиксисе Мурсалимов С.Р. XII Всероссийская молодежная школа-конференция по актуальным проблемам химии и биологии, Владивосток |
|
| Особенности цитомиксиса в материнских клетках пыльцы высших растений Мурсалимов С.Р. XLVII Международная научная студенческая конференция "Студент и научно-технический прогресс" (МНСК-47) г.Новосибирск, 11 – 15 апреля 2009 г. |
|
| Цитомиксис у трансгенных растений табака Сидорчук Ю.В., Мурсалимов С.Р., Дейнеко Е.В. Хромосома 2009, Новосибирск, 31 августа - 6 сентября |
|
| 2008 | A phenomenon of plant abnormal spindle repare is revealed (oral). 2.Correction of abnormal spindle by its chaotization and re-assembly (poster) N.V. Shamina Gordon Research Conference, Symposium "Plant & Fungal Cytoskeleton", Lucca (Il Ciocco), Italy |
| Морфофизиологические изменения у трансгенных растений табака при спонтанной полиплоидизации в культуре in vitro Загорская А.А., Сидорчук Ю.В., Дейнеко Е.В. IV Международная научная конференция "Факторы экспериментальной эволюции организмов". Алушта. 22-26 сентября |
|
| Трансгенные растения как модели для фундаментальных исследований Дейнеко Е.В. Генетика и селекция растений, основанная на современных генетических знаниях и технологиях. Звенигород |
|
| Молекулярно-генетический анализ мозаичного характера проявления маркерного гена nptII у трансгенных растений табака Логинова Д.Б., Дейнеко Е.В. Факторы экспериментальной эволюции организмов. г. Алушта, Крым, Украина |
|
| Мозаичный характер экспрессии маркерного гена nptII у трансгенных растений табака линии Nu 21 Логинова Д.Б., Дейнеко Е.В. IX международная конференция "Биология клеток растений in vitro и биотехнология |
|
| Инактивация перенесенных генов в трансгенных растениях табака: мозаичный характер экспрессии маркерного гена nptII Логинова Д.Б., Дейнеко Е.В. Генетика и селекция растений, основанная на современных генетических знаниях и технологиях |
|
| 2007 | Встраивание векторных последовательностей в геном трансгенных растений Пермякова Н.В., Дейнеко Е.В. VIII Съезд Украинского общества генетиков и селекционеров им. Н.И. Вавилова, Алушта, Украина, 24-28 сентября |
| Мутантный фенотип и динамика ИУК в цветках трансгенных растений табака Сидорчук Ю.В., Загорская А.А., Дейнеко Е.В., Шумный В.К. VIII Съезд Украинского общества генетиков и селекционеров им. Н.И. Вавилова, Алушта, Украина, 24-28 сентября |
|
| Встраивание векторных последовательностей в геном трансгенных растений табака и моркови Пермякова Н.В., Дейнеко Е.В. Международная конференция "Генетика в России и мире" |
|
| Генетически модифицированные растения моркови - продуценты белков медицинского назначения Дейнеко Е.В., Загорская А.А., Филипенко Е.А., Сидорчук Ю.В., Пермякова Н.В., Сенников С.В., Лопатникова Ю.А., Козлов В.А., Филипенко М.Л, Храпов Е.А., Шумный В.К. Международный Междисциплинарный Симпозиум "От экспериментальной биологии к превентивной и интегративной медицине", 17-27 сентября 2006 г., Судак, Крым, Украина |
|
| Genome synteny of Pea and model Legumes: From mutation through genetic mapping to the genes. V. A. Zhukov, A. Y. Borisov, E. V. Kuznetsova, L. H. Madsen, M. D. Moffet, E. S. Ovchinnikova, A. G. Pinaev, S. Radutoiu, S. M. Rozov, T. S. Rychagova, O. Y. Shtark, V. E. Tsyganov, V. A. Voroshilova, J. Stougaard, N. F. Weeden and I. A. Tikhonovich. The 15th International Nitrogen Fixation Congress and the 12th International Conference of the African Association for Biological Nitrogen Fixation. |
|
| 2006 | Catalogue of phragmoplast/cell plate abnormalities : a tool for plant cytokinesis study Shamina N.V. Gordon Research Conference "Plant & Fungal Cytoskeleton" Andover (New Haempshire), USA, 22-25 August 2006 |
| Изучение морфологии цветка и снижение уровня фертильности у трансгенных растений табака (Nicotiana tabacum L., линия SR1) Сидорчук Ю.В., Дейнеко Е.В., Загорская А.А., Шумный В.К. Всероссийская научная конференция "Структура и экспрессия митохондриального генома растений", Иркутск, 3-7 сентября 2006 г. |
 Гранты
Гранты
| 2017 | Разработка фундаментальных основ увеличения биосинтеза рекомбинантных белков в культурах клеток высших растений Российский научный фонд, номер гранта 17-14-01099 |
| 2016 | Исследование цитологических механизмов и оценка эволюционного значения цитомиксиса в мейозе высших растений РФФИ, номер гранта 16-34-60007 мол_а_дк |
| 2015 | Организация 3-ей Международной конференции «Генетика, геномика, биоинформатика и биотехнология растений» РФФИ, номер гранта 15-04-20430 |
| 2014 | Цитомиксис в микроспорогенезе табака: исследование судьбы мигрирующего хроматина РФФИ, номер гранта 14-04-00992а |
| Изучение формирования и функционирования цитомиктических каналов в вегетативных и генеративных клетках РФФИ, номер гранта 14-04-90414а |
|
| Оценка эффективности тканеспецифичных регуляторных последовательностей в гетерологичных растительных системах РФФИ, номер гранта 14-34-50689мол_нр |
|
| 2012 | Изучение особенностей межклеточной коммуникации высших растений в ходе мейотического деления Carl Zeiss |
| 2011 | Контракт № 214 на выполнение научно-исследовательских и опытно-конструкторских работ от 19.09.2011 г. по теме «Выявление вариантов возможных технический решений ВТР СР, входящих в состав НДГ и НДИ по результатам первого, второго и третьего этапов секвенирования». Номер гранта 214 |
| Бюджетный проект "Анализ молекулярного состава прицентромерного района Х-хромосомы Aeropus Sibiricus" |
|
| Выявление причин и механизмов межклеточного перемещения хроматина в материнских клетках пыльцы у трансгенных растений табака РФФИ, номер гранта 11-04-01192а |
|
| 2010 | Конструирование онколитических вирусов Министерством образования и науки, номер гранта № 11.G34.31.0034 |
| 2009 | Создание трансформированной клеточной линии растений с высокой эффективностью синтеза гетерологичного белка Национальный Центр Биотехнологии Республики Казахстан, номер гранта 53/2010 |
| Разработка технологии получения трансгенных растений, экспрессирующих антигены возбудителя туберкулеза и иммуномодулирующие медиаторы Национальный Центр Биотехнологии Республики Казахстан, номер гранта 45/2011 |
|
| Разработка генно-инженерной платформы нового поколения для экспрессии целевых генов в составе внеядерных геномов клеток СО РАН, номер гранта №7 |
|
| 2008 | Разработка моделей на основе трансгенных растений с генами IL18 человека и esat6 M.tuberculosis для оценки формирования специфического иммунного ответа при пероральной доставке рекомбинантных белков в организм животных Федеральное агенство по науке и инновациям, номер гранта НШ-1814.2008.4 |
| Молекулярно-генетический анализ мозаичного характера проявления маркерного гена nptII у трансгенных растений табака РФФИ, номер гранта 08-04-00954 |
|
| Изучение особенностей цитомиксиса на примере трансгенных растений табака с мутантным фенотипом РФФИ, номер гранта 08-04-01046а |
|
| 2007 | Анализ механизмов транспорта иммуноактивных медиаторов через кишечный эпителий на модели трансгенных растений моркови с генами интерлейкинов 10 и 18 человека для пероральной доставки иммунорегуляторных препаратов Федеральное Агенство по науке и инновациям, номер гранта 02.512.11.2109 |
| 2006 | Хромосомная и генетическая инженерия как метод изучения генома и экспрессии генов у растений Грант Президента РФ для поддержки ведущих научных школ, номер гранта НШ-528-2006.4 |
| Изучение особенностей модификации генома у трансгенных растений и разработка оптимальной системы экспрессии целевых генов РАН, номер гранта Программа РАн "Биоразнообразие и динамика генофондов" Направление - "Фундаментальные проблемы трансгенеза растений и животных" |
|
| 2005 | Создание трансгенных растений-биопродуцентов белков медицинского назначения с иммуномодулирующим действием Федеральное агенство по науке и инновациям, номер гранта 02.435.11.3013 |
| "Development of edible vaccines using transgenic plants" Международный научно-технический центр, номер гранта №1276 |
|
| Молекулярно-генетический анализ трансгенных растений: изучение районов интеграции Т-ДНК инсерций в ядерный геном РФФИ, номер гранта 05-04-48925 |
|
| 2004 | Эпигенетическое наследование репродуктивных признаков у растений РФФИ, номер гранта РФФИ № 04-04-48176-а |
 Научное руководство
Научное руководство
| 2014 | Формирование веретена деления в мейозе полигаплоидных растений Роговая Анастасия Александровна , 2014-06-03 |
| 2013 | ЦИТОМИКСИС В МИКРОСПОРОГЕНЕЗЕ ОДНОДОЛЬНЫХ И ДВУДОЛЬНЫХ РАСТЕНИЙ РАЗЛИЧНОГО УРОВНЯ ПЛОИДНОСТИ Новиковская Анна Алексеевна , 2013-06-11 |
| 2011 | Динамика тубулинового цитоскелета в материнских клетках пыльцы растений табака (Nicotiana tabacum L.) при увеличении уровня плоидности. Киняйкин Владимир Игоревич , 2011-06-03 |
| 2010 | Динамика микротрубочкового цитоскелета в аномальном мейозе у трансгенных растений табака (N.tabacum L.) Сидорчук Юрий Владимирович 2010-05-19 |
| 2009 | «Cоздание трансгенных растений табака с геном белка оболочки вируса гепатита В» Моисеенко А.В. 2009-06-06 |
| «Особенности цитомиксиса в материнских клетках пыльцы высших растений» Мурсалимов С.Р. 2009-06-03 |
|
| «Cпонтанные мутации устойчивости к спектиномицину при получении транспластомных растений моркови» Жариков Т.Ю. 2009-06-03 |
|
| «Особенности встраивания векторных последовательностей в геном трансгенных растений моркови Daucus carota L.» Калымбетов А.А. 2009-05-30 |
|
| 2008 | «Анализ сайтов встраивания Т-ДНК у трансгенных растений моркови (Daucus carota L.) и табака Nicotiana tabacum L.» Дулимов М.М. 2008-06-05 |
| Встраивание векторных последовательностей в геном трансгенных растений табака (Nicotiana tabacum L.) и моркови (Daucus carota L.) Пермякова Наталья Владиславовна 2008-05-14 |
|
| 2007 | «Изучение мозаичного характера проявления маркерного гена nptII в трансгенных растениях линии Nu21 Nicotiana tabacum L.» Логинова Д.Б. 2007-05-30 |
| Шелемба А.А. «Цитологический анализ цитомиксиса в материнских клетках пыльцы у трансгенных растений табака Nicotiana tabacum L.» Шелемба А.А. 2007-05-30 |
|
| Анализ изменчивости по морфогенетическим реакциям in vitro моркови Барабошкина А.В. 2007-05-28 |
|
| 2006 | «Цитомиксис у трансгенных растений табака Nicotiana tabacum L.» Шаталина М.Н. 2006-06-03 |
| 2005 | Изучение стабильности экспрессии чужеродных генов у трансгенных растений табака (Nicotiana tabacum L.) Маренкова Татьяна Владиславовна , 2005-06-10 |
 Учебные курсы
Учебные курсы
| 2017 | Концепции современного естествознания Розов С.М. НГУ Психологический факультет, семестров: 1 |
| 2016 | Методы молекулярной генетики НГУ, кафедра цитогии и генетики, семестров: 1 |
| Концепции современного естествознания НГУ, факультет психологии, семестров: 1 |
|
| 2015 | Методы молекулярной генетики Павел Белавин, Мария Пахарукова, Михаил Помазной Новосибирский Государственный Университет, кафедра цитологии и генетики, семестров: 1 |
| Концепции современного естествознания НГУ, факультет психологии, семестров: 1 |
|
| 2014 | Концепции современного естествознания Розов С.М. НГУ, семестров: 1 |
| 2013 | Концепции современного естествознания Розов С.М. НГУ, семестров: 1 |
| 2012 | Концепции современного естествознания НГУ, Психологический факультет, семестров: 1 |
| 2011 | Практикум по молекулярной биологии Татьков С.И., Белавин П.А. НГУ, кафедра цитологии и генетики, семестров: 1 |
| Концепии современного естествознания НГУ Психологический факультет, семестров: 1 |
|
| 2010 | Концепции современного естествознания Cеместров: 1 |
| 2009 | Концепции современного естествознания Cеместров: 1 |
| 2008 | Концепции современного естествознания Cеместров: 1 |
| 2007 | Концепции современного естествознания Cеместров: 1 |
| 2006 | Биотехнология и генная инженерия растений Томский госуниверситет, кафедра физиологии растений и биотехнологии, семестров: 1 |
| Концепции современного естествознания Cеместров: 1 |
 Патенты
Патенты
| 2011 | Рекомбинантная плазмида pBI121-ESAT6-CFP10-gIFN, кодирующая белки ESAT6 и CFP10 Mycobacterium tuberculosis, и γ-интерферон человека в трансгенных растениях Татьков С. И., Дейнеко Е. В., Белавин П. А., Загорская А. А., Филипенко Е. А., Уварова Е. А., Какимжанова А. А., Раманкулов Е. М. |
| 2009 | «Способ получения трансгенных растений моркови, продуцирующих интерлейкин -10 человека». Дейнеко Е.В., Шумный В.К., Филипенко Е.А., Загорская А.А., Сидорчук Ю.В., Филипенко М.Л.,Власов В.В., Сенников С.В., Козлов В.А., Якушенко Е.В. Номер патента № 374321 |
| Название Способ получения трансгенных растений моркови, продуцирующих интерлейкин-10 человека Дейнеко Е.В., Шумный В.К., Филипенко Е.А., Загорская А.А., Сидорчук Ю.В., Филипенко М.Л., Власов В.В., Сенников С.В., Козлов В.А., Якушенко Е.В. (10) Номер патента 2374321 |
|
| Способ культивирования in vitro клеточной культуры трансгенного табака Nicotiana tabacum L., содержащего ген интерлейкина-18 человека Карначук Р.А., Гвоздева Е.С., Дейнеко Е.В., Глухова Л.Б., Дорофеев В.Ю. Номер патента 2354692 |
| © 2010-2026 ИЦиГ СО РАН. Все права защищены. |