Система учета научной деятельности (ASSA) |


|
Лаборатория генетики стресса (т.04)Отдел генетики насекомых (т.104)
Научные результаты Сотрудники О Подразделении 1. Основное направление исследований Исследование молекулярно-генетических механизмов взаимодействия стресс-связанных гормонов и инсулиноподобных факторов роста насекомых и их роли в адаптации к неблагоприятным условиям, с использованием Drosophila melanogaster в качестве модельного объекта. Задачи, решаемые в рамках основного направления на данном этапе:
2. Аннотация базового бюджетного проекта подразделения Бюджетный проект VI.53.2.3. «Исследование генетико-физиологических и молекулярных механизмов нейроэндокринной регуляции висцеральных функций и поведения, обеспечивающих гомеостаз» (координатор проекта: академик РАН Л. Н. Иванова). В рамках проекта запланирована проверка гипотезы о том, что гены инсулинового сигнального пути могут контролировать развитие нейроэндокринной стресс-реакции насекомых и половой диморфизм по устойчивости к действию стрессоров. Лаборатория генетики стресса отвечает за блок 2 бюджетного проекта: «Молекулярно-генетический механизм взаимодействия генов инсулинового и дофаминового сигнальных путей в развитии нейроэндокринной стресс-реакции и контроле полового диморфизма по стрессоустойчивости (модель Drosophila)» (отв. исполнитель - д.б.н. Н.Е. Грунтенко).
3. Прикладные разработки В перспективе возможно использование D. melanogaster с нарушениями в уровне продукции инсулиноподобных белков в качестве модели для изучения диабета первого типа, а с нарушением экспрессии инсулинового рецептора – в качестве модели для изучения диабета второго типа.
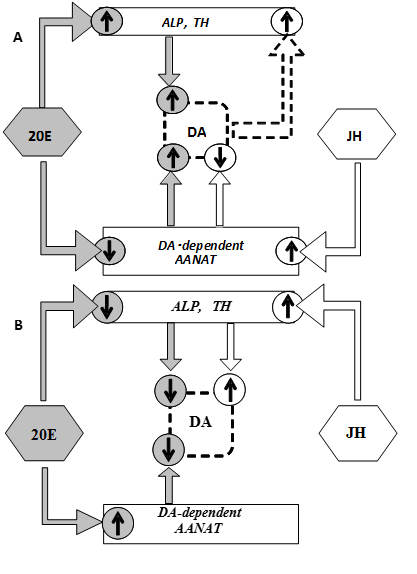
4. Иллюстрированное описание лучших результатов, полученных подразделением за последние 5 лет Исследован механизм онтогенетических изменений в характере регуляции уровня дофамина ювенильным гормоном и 20-гидроксиэкдизоном у самок дрозофилы. Известно, что дофамин опосредует ряд нейральных и эндокринных функций как у позвоночных, так и у беспозвоночных. Дофаминовые сигнальные пути участвуют в регуляции агрессии, гормонального контроля сексуального поведения, контроля моторной и репродуктивной функций, устойчивости к действию стрессоров (Neckameyer, Leal, 2002. In: Hormones Brain and Behavior, 141-165). Мы показали, что у имаго дрозофилы дофамин находится в сложных, изменяющихся с возрастом, отношениях взаиморегуляции с гонадотропинами, ювенильным гормоном (ЮГ) и 20-гидроксиэкдизоном (20Э) (Gruntenko, Rauschenbach, 2008. J Insect Physiol. 56:902–908). Мы обнаружили, что стадия-специфичность воздействия ЮГ и 20Э на уровень дофамина у самок дрозофилы обусловлена различной направленностью воздействия этих гормонов у молодых и половозрелых самок на активность щелочной фосфатазы (ALP) – фермента, определяющего пул предшественника дофамина (тирозина), тирозингидроксилазы (TH) - скоростьлимитирующего фермента синтеза дофамина, и дофамин-зависимой N-ацетилтрансферазы (ДА-dependent AANAТ) – основного фермента деградации дофамина (Рис. 1).
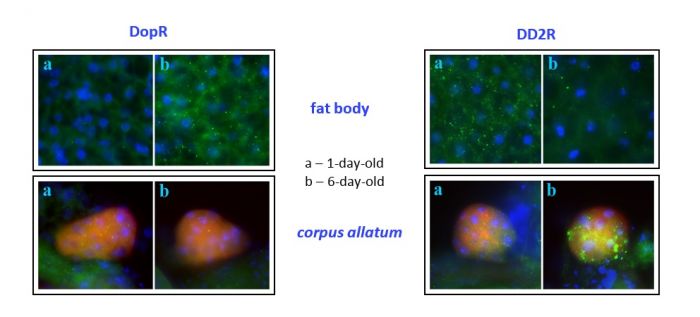
Обнаружено, что ингибирующее влияние дофамина на синтез и деградацию ювенильного гормона опосредуется Д2-подобными, а активирующее Д1-подобными рецепторами. Известно, что физиологические функции дофамина опосредуют два семейства G-протеин-сопряженных рецепторов: Д1-подобные (активирующие) и Д2-подобные (ингибирующие). Эти рецепторы высоко консервативны у млекопитающих, человека в частности, и дрозофилы, в силу чего последняя является удобной моделью для исследования молекулярно-генетического механизма взаимодействия стресс-связанных гормонов (Vallone et al., 2000. Neurosci Biobehav R. 24:125–132). Необходимо подчеркнуть, что хотя интерес к структуре и функционированию дофаминовых рецепторов в мире очень велик, исследование опосредованной ими регуляции метаболизма гонадотропных гормонов в контроле приспособленности осуществлено нами впервые. Мы провели иммуногистохимический анализ экспрессии Д1- и Д2-подобных рецепторов в тканях, ответственных за продукцию ЮГ и ферментов его деградации, у молодых и половозрелых самок дрозофилы (рис. 2), и показали, что переключение направленности действия дофамина на метаболизм ЮГ связано с происходящим с возрастом изменением уровня экспрессии Д1- иД2-подобных рецепторов в этих тканях (железе corpus allatum, синтезирующей ЮГ, и жировом теле, синтезирующем ферменты его деградации).
Рисунок 2. Экспрессия Д1- (DopR) и Д2-подобных (DD2R) рецепторов (зеленый сигнал, иммуногистохимическое окрашивание) в клетках corpus allatum (красный сигнал) и жирового тела (fat body) у молодых [а] и половозрелых [b] самок D. melanogaster (Gruntenko et al., J Insect Physiol. 2012. 58:1534-1540).
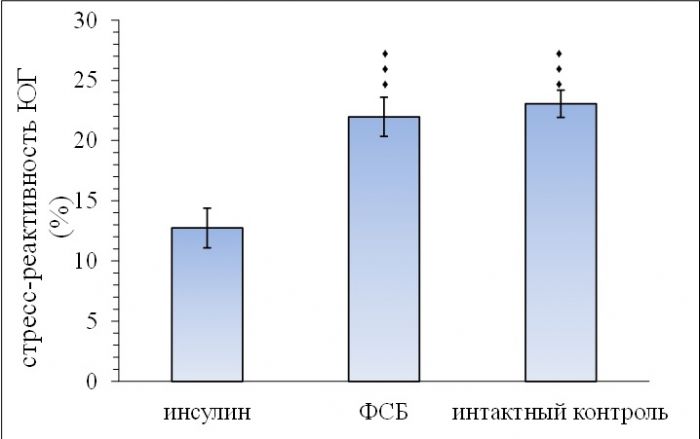
Продемонстрировано участие инсулинового сигнального пути в регуляции метаболизма стресс-связанных гормонов, дофамина и ювенильного гормона, у самок дрозофилы в нормальных условиях и при тепловом стрессе. Инсулиновый сигнальный путь, существующий у всех многоклеточных организмов, участвует в регуляции различных функций, включая рост, развитие, размножение, метаболический гомеостаз, продолжительность жизни и устойчивость к стрессу. Этот путь консервативен от дрозофилы до человека, что позволяет использовать D. melanogaster в качестве удобного модельного объекта для его изучения (Tatar et al. 2003. Science. 299:1346–1351; Broughton et al. 2005. PNAS. 102:3105-3110). Мы впервые продемонстрировали, что подавление экспрессии гена инсулинового рецептора InR у самок D. melanogaster и обработка инсулином приводят к изменениям в метаболизме ЮГ и дофамина в нормальных условиях, а также влияют на интенсивность стресс-реакции (рис. 3).
Рисунок 3. Влияние инъекции инсулина на стресс-реактивность ЮГ (процент падения уровня деградации ЮГ при стрессе по отношению к его уровню в нормальных условиях) у самок D. melanogaster. ФСБ – инъекция фосфатно-солевого буфера.
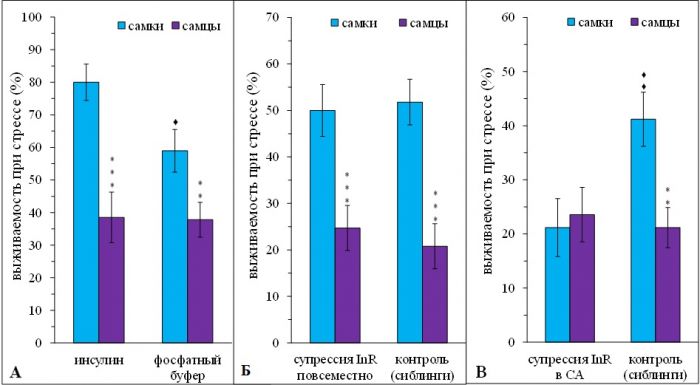
Показано, что половой диморфизм дрозофилы по стрессоустойчивости исчезает при подавлении экспрессии гена инсулиноподобного рецептора (InR) в corpus allatum – железе, синтезирующей ювенильный гормон. Ранее мы обнаружили, что у Drosophila существует половой диморфизм по устойчивости к действию стрессоров: выживаемость самок при тепловом стрессе (38°C) или при голодании существенно превышает выживаемость самцов (Gruntenko et al., Insect Mol. Biol. 2003. 12:353–363; Gruntenko et al., Arch. Insect Biochem. Physiol. 2004. 55:55–67). Как оказалось, у имаго дрозофилы инсулин повышает устойчивость самок, но не самцов, к тепловому стрессу (Рис. 4А). Мы показали, что инсулиновый сигнальный путь регулирует половой диморфизм дрозофилы по устойчивости к стрессу, и эта регуляция опосредуется ЮГ, поскольку нокдаун гена InR специфически в corpus allatum (Рис. 4В) аннулирует половой диморфизм, а при повсеместном подавлении его экспрессии этого не происходит (Рис. 4Б).
Рисунок 4. Влияние теплового стресса на выживаемость самок и самцов линии дикого типа D. melanogaster, инъецированных инсулином (А), при повсеместном подавлении экспрессии инсулинового рецептора (Б) и при ее подавлении в corpus allatum (В).
5. Задачи, планируемые на перспективу
Адоньева Наталья Васильевна [старший научный сотрудник] Андреенкова Ольга Владимировна [научный сотрудник] Бобровских Маргарита Александровна [научный сотрудник] Бурдина Елена Владимировна [научный сотрудник] Гусельникова Светлана Владимировна [старший лаборант] Дерюженко Максим Алексеевич [младший научный сотрудник] Ефимов Вадим Михайлович [ведущий научный сотрудник] Карпова Евгения Константиновна [старший научный сотрудник] Фаддеева Наталья Владимировна [ведущий инженер] Шишкина Ольга Дмитриевна [младший научный сотрудник] Бывшие сотрудникиБогомолова Елена ВладимировнаЛаухина Ольга Владимировна Раушенбах Инга Юрьевна Ченцова Надежда Алексеевна Шубина Тамара Николаевна Выберите слайдером нужный промежуток, и список ниже будет содержать записи только нужного периода: 89 90 91 92 93 94 95 96 97 98 99 00 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Публикации Монографии Конференции Гранты Научное руководство Учебные курсы Патенты
|
| 2025 | Symbiosis of intracellular bacteria Wolbachia with insects: a hundred years of study summarized O.D. Shishkina , N.E. Gruntenko Vavilov journal of genetics and breeding, 2025, 29(1):79-91 |
| Mating affects dopamine signaling in Drosophila melanogaster females Elena V. Burdina, Margarita A. Bobrovskikh, Natalya V. Adonyeva, Alexander A. Alekseev, Olga V. Andreenkova, Maksim A. Deryuzhenko, Olga D. Shishkina, Evgenia K. Karpova, Nataly E. Gruntenko INSECT SCI, 2025 |
|
| База знаний FlyDEGdb по дифференциально экспрессирующимся генам Drosophila melanogaster - модельного объекта биомедицины Подколодная О.А., Дерюженко М.А., Твердохлеб Н.Н, Золотарева К.А., Маковка Ю.В., Подколодный Н.Л., Суслов В.В., Чадаева И.В., Федосеева Л.А., Серяпина А.А., Ощепков Д.Ю., Богомолов А.Г., Кондратюк Е.Ю., Редина О.Е., Маркель А.Л., Грунтенко Н.Е., Пономаренко М.П. Vavilov journal of genetics and breeding, 2025, 7, 29, 952-962 |
|
| The role of dopamine in Drosophila melanogaster Meigen, 1830 fitness under chronic stress E.K. Karpova, N.V. Adonyeva, M. A. Deryuzhenko, N. E. Gruntenko Евразиатский энтомологический журнал, 2025, 24(5): 239–243 |
|
| The effect of early stress on Drosophila melanogaster development and fertility. Adonyeva N.V., Efimov V.M., Gruntenko N.E. Doklady Biological Sciences, 2025, том 525, с. 668–671 |
|
| Analysis of the Protein-Protein Interaction of CREBBP, HTT, and KMT2D by Principal Components Method I. I. Khegai, R. Gong, V. M. Efimov RUSS J BIOORG CHEM+, 2025, Vol. 51, No. 6, pp. 2652–2659 |
|
| The influence of allelic variants at the Vrn-A1 gene
on the duration of the vegetation period in Triticum dicoccoides Chepurnov G.Yu., Chen Z., Blinov A.G. , Efimov V.M., Goncharov N.P. Vavilov journal of genetics and breeding, 2025, 29(8):1277-1287 |
|
| 2024 | Fertility differences between two wild-type Drosophila melanogaster lines correlate with differences in the expression of the Jheh1 gene, which codes for an enzyme degrading juvenile hormone O V Andreenkova, N V Adonyeva, V M Efimov, N E Gruntenko Vavilov journal of genetics and breeding, 2024, 28(2):185-189 |
| Многомерный анализ многолетних климатических данных в связи с урожайностью, скороспелостью
и проблемой глобального потепления Ефимов В.М., Речкин Д.В., Гончаров Н.П. Vavilov journal of genetics and breeding, 2024, т.28(2), с. 155-165. |
|
| Two old wild-type strains of Drosophila melanogaster can serve as an animal model of faster and slower aging processes Lyudmila P. Zakharenko, Margarita A. Bobrovskikh, Nataly E. Gruntenko, Dmitriy V. Petrovskii, Evgeniy G. Verevkin, Arcady A. Putilov Insects, 2024, 15(5), 329 |
|
| Larval Heat Stress Affects the Lifespan and Stress Resistance of Drosophila melanogaster Adults. E. K. Karpova, E. V. Burdina, V. M. Efimov, N. E. Gruntenko. Adv. Gerontol, 2024, Vol. 13, No. 4, pp. 196–201 |
|
| Larval stress affects adult Drosophila behavior and metabolism Evgenia K. Karpova , Margarita A. Bobrovskikh , Elena V. Burdina , Natalya V. Adonyeva , Maksim A. Deryuzhenko , Lyudmila P. Zakharenko , Dmitriy V. Petrovskii , Nataly E. Gruntenko J INSECT PHYSIOL, 2024, 159, 104709 |
|
| Structural Analysis of the LZTFL1 Protein by Principal Component Analysis (PCA-seq) I.I. Khegai, X. Yu, V.M. Efimov RUSS J BIOORG CHEM+, 2024, Vol. 50, No. 6, pp. 2611–2617. |
|
| 2023 | Effects of Positive Fighting Experience and Its Subsequent Deprivation on the Expression Profile of Mouse Hippocampal Genes Associated with Neurogenesis Redina O.E., Babenko V.N., Smagin D.A., Kovalenko I.L., Galyamina A.G., Efimov V.M., Kudryavtseva N.N. INT J MOL SCI, 2023, Int. J. Mol. Sci. 2023, 24, 3040 |
| A new effective method for quantitative estimation of changes in Drosophila fat reserves using magnetic resonance imaging Мargarita А. Bobrovskikh, Еvgenia К. Karpova, Аnna S. Khotskina, Мaksim А. Deryuzhenko, Nataly Е. Gruntenko ARCH INSECT BIOCHEM, 2023, Volume 113, Issue 2, e22007 |
|
| Motus Vita Est: Fruit Flies Need to Be More Active and Sleep Less to Adapt to Either a Longer or Harder Life Lyudmila P. Zakharenko, Dmitrii V. Petrovskii, Margarita A. Bobrovskikh, Nataly E. Gruntenko, Ekaterina Y. Yakovleva, Alexander V. Markov, Arcady A. Putilov Clocks & Sleep (MDPI), 2023, 5(1), 98-115 |
|
| Wolbachia Effect on Drosophila melanogaster Lipid and Carbohydrate Metabolism Evgenia K. Karpova, Margarita A. Bobrovskikh, Maksim A. Deryuzhenko, Olga D. Shishkina, and Nataly E. Gruntenko Insects, 2023, 14, 357 |
|
| Mechanisms of Neuroendocrine Stress Response in Drosophila and Its Effect on Carbohydrate and Lipid Metabolism Margarita A. Bobrovskikh, Nataly E. Gruntenko Insects, 2023, 14(5), 474 |
|
| Genetic Dissection of Spike Productivity Traits in the Siberian Collection of Spring Barley Irina V. Rozanova, Yuriy N. Grigoriev, Vadim M. Efimov, Alexander V. Igoshin, Elena K. Khlestkina Biomolecules, 2023 |
|
| The Role of 20-Hydroxyecdysone in the Control of Carbohydrate Levels in Drosophila melanogaster under Short-Term Heat Stress M. A. Bobrovskikh, N. E. Gruntenko Doklady Biochemistry and Biophysics, 2023, V. 511, P. 162–165 |
|
| Accurate noise-robust classification of
Bacillus species from MALDI-TOF MS spectra
using a denoising autoencoder Yulia E. Uvarova, Pavel S. Demenkov, Irina N. Kuzmicheva, Artur S. Venzel, Elena L. Mischenko, Timofey V. Ivanisenko, Vadim M. Efimov, Svetlana V. Bannikova, Asya R. Vasilieva, Vladimir A. Ivanisenko and Sergey E. Peltek J INTEGR BIOINFORM, 2023 |
|
| The effect of genotype combinations of Wolbachia and its Drosophila melanogaster host on fertility, developmental rate and heat stress resistance of the flies N.V. Adonyeva, V.M. Efimov, N.E. Gruntenko Insects, 2023, 14(12), 928 |
|
| Drosophila melanogaster Transcriptome Response to Different Wolbachia Strains Gruntenko, N.E.; Deryuzhenko, M.A.; Andreenkova, O.V.; Shishkina, O.D.; Bobrovskikh, M.A.; Shatskaya, N.V.; Vasiliev, G.V. INT J MOL SCI, 2023, 24, 17411 |
|
| A Putative Locus for Cranial-Size Variability
of the Fox (Vulpes vulpes) A.V. Kharlamovaa, S.G. Shikhevich, A.V. Vladimirova, A.V. Kukekova, V.M. Efimov RUSS J GENET+, 2023, Vol. 59, No. 5, pp. 466–482 |
|
| 2022 | Relationship between the characteristics of bread wheat grains, storage time and germination Dmitry A. Afonnikov. Evgenii G. Komyshev, Vadim M. Efimov, Mikhail A. Genaev, Vasily S. Koval, Peter U. Gierke and Andreas Börner Plants, 2022, v. 11, p. 35 |
| Classification of Fruit Flies by Gender in Images Using
Smartphones and the YOLOv4-Tiny Neural Network Mikhail A. Genaev, Evgenii G. Komyshev, Olga D. Shishkina, Natalya V. Adonyeva, Evgenia K. Karpova, Nataly E. Gruntenko, Lyudmila P. Zakharenko, Vasily S. Koval and Dmitry A. Afonnikov Mathematics, 2022, v. 10, p. 295 |
|
| Physiological Aspects of Wolbachia pipientis–Drosophila melanogaster Relationship E. V. Burdina, N. E. Gruntenko J EVOL BIOCHEM PHYS+, 2022, V. 58, P. 303–317 |
|
| Molecular mechanisms of exceptional lifespan
increase of Drosophila melanogaster with different
genotypes after combinations of pro-longevity
interventions Mikhail V. Shaposhnikov, Zulfiya G. Guvatova, Nadezhda V. Zemskaya, Liubov A. Koval, Eugenia V. Schegoleva, Anastasia A. Gorbunova, Denis A. Golubev, Natalya R. Pakshina, Natalia S. Ulyasheva, Ilya A. Solovev, Margarita A. Bobrovskikh, Nataly E. Gruntenko, Petr N. Menshanov, George S. Krasnov, Anna V. Kudryavseva, Alexey A. Moskalev Commun. biolog., 2022, 5, 566 |
|
| Скороспелость и морфотип сортов мягкой пшеницы Западной и Восточной Сибири Смоленская С.Э., Ефимов В.М., Кручинина Ю.В., Немцев Б.Ф., Чепурнов Г.Ю., Овчинникова Е.С., Белан И.А., Зуев Е.В., Чжоу Чэньси, Пискарев В.В., Гончаров Н.П. Vavilov journal of genetics and breeding, 2022, Т. 26, № 7. С. 662-674. |
|
| Easy and Effective Method for Extracting and Purifying Wolbachia Genomic DNA Andreenkova O.V., Shishkina O.D., Klimenko A.I., Korenskaia A.E., Bobrovskikh M.A., Shatskaya N.V., Vasiliev G.V., Gruntenko N.E. INT J MOL SCI, 2022, 23(23), 15315 |
|
| Влияние теплового стресса на активность щелочной фосфатазы у короедов Ips amitinus (Eichhoff, 1872) и Polygraphus proximus Blandford, 1894 (Coleoptera, Curculionidae: Scolytinae) (Effect of heat stress on alkaline phosphatase activity in bark beetles Ips amitinus (Eichhoff, 1872) and Polygraphus proximus Blandford, 1894 (Coleoptera, Curculionidae: Scolytinae)) Бурдина Е.В., Керчев И.А., Смирнов Н.A., Грунтенко Н.Е. Евразиатский энтомологический журнал, 2022, 21(5): 258–264 |
|
| New Wolbachia pipientis Genotype Increasing Heat Stress Resistance of Drosophila melanogaster Host Is Characterized by a Large Chromosomal Inversion Korenskaia A.E., Shishkina O.D., Klimenko A.I., Andreenkova O.V., Bobrovskikh M.A., Shatskaya N.V., Vasiliev G.V., Gruntenko N.E. INT J MOL SCI, 2022, 23(24), 16212 |
|
| Редкие генотипы Wolbachia в лабораторных линиях Drosophila melanogaster А.С. Рябинин, О.Д. Шишкина, Ю.Ю. Илинский, Р.А. Быков Vavilov journal of genetics and breeding, 2022, Том 26, № 6 |
|
| 2021 | Fitness Analysis and Transcriptome Profiling Following Repeated Mild Heat Stress of Varying Frequency in Drosophila melanogaster Females Gruntenko NE, Karpova EK, Babenko VN, Vasiliev GV, Andreenkova OV, Bobrovskikh MA, Menshanov PN, Babenko RO, Rauschenbach IY. Biology, 2021, 10(12):1323 |
| Unique Wolbachia strain wMelPlus increases
heat stress resistance in Drosophila melanogaster Elena V. Burdina, Roman A. Bykov, Petr N. Menshanov, Yury Yu. Ilinsky, Nataly Е. Gruntenko ARCH INSECT BIOCHEM, 2021, 106:e21776 |
|
| Транскрипционный фактор dFOXO регулирует экспрессию генов инсулинового сигнального каскада и содержание липидов при тепловом стрессе у Drosophila melanogaster Еремина М.А., Меньшанов П.Н., Шишкина О.Д., Грунтенко Н.Е. Vavilov journal of genetics and breeding, 2021, 2021;25(5):465-471 |
|
| A Link between Atmospheric Pressure and Fertility of Drosophila Laboratory Strains Natalya V. Adonyeva, Petr N. Menshanov, Nataly Е. Gruntenko Insects, 2021, 12, 947 |
|
| 2020 | Адаптация сульфофосфованилинового метода анализа
общих липидов для различных биологических объектов
на примере Drosophila melanogaster М.А. Еремина, Н.Е. Грунтенко Vavilov journal of genetics and breeding, 2020, 24(4):441-445 |
| Quantifying Drosophila adults with the use of a smartphone Evgenia K. Karpova, Evgenii G. Komyshev, Mikhail A. Genaev, Natalya V. Adonyeva, Dmitry A. Afonnikov, Margarita A. Eremina, Nataly E. Gruntenko Biology Open, 2020, 9: bio054452 |
|
| First person – Evgeniya Karpova and Evgenii Komyshev Evgeniya Karpova, Evgenii Komyshev Biology Open, 2020, 9: bio056622 |
|
| 2019 | Mutations in the Insulin Signaling Pathway Genes Affect Carbohydrate Level under Heat Stress in Drosophila melanogaster Females M. A. Eremina, E. K. Karpova, I. Yu. Rauschenbach, D. S. Pirozhkova, O. V. Andreenkova & N. E. Gruntenko RUSS J GENET+, 2019, Volume 55, pages 519–521 |
| Генотип эндосимбионта Wolbachia pipientis влияет на метаболизм октопамина у самок Drosophila melanogaster Н. В. Адоньева, Е. В. Бурдина, Р.А. Быков, Н. Е. Грунтенко, И. Ю. Раушенбах RUSS J GENET+, 2019, том 55, №5 |
|
| Drosophila female fertility and juvenile hormone metabolism depends on the type of Wolbachia infection Nataly E. Gruntenko, Evgenia K. Karpova, Natalya V. Adonyeva, Olga V. Andreenkova, Elena V. Burdina, Yury Yu. Ilinsky, Roman A. Bykov, Petr N. Menshanov, Inga Yu. Rauschenbach J EXP BIOL, 2019, 222, jeb195347 |
|
| Prevalence and genetic diversity of Wolbachia endosymbiont and mtDNA in Palearctic populations of Drosophila melanogaster Roman А. Bykov, Maria A. Yudina, Nataly E. Gruntenko, Ilya K. Zakharov, Marina A. Voloshina, Elena S. Melashchenko, Maria V. Danilova, Ilia O. Mazunin, Yury Yu. Ilinsky BMC EVOL BIOL, 2019, 19(Suppl 1):48 |
|
| Stress‐related hormones affect carbohydrate metabolism in Drosophila females Evgenia K. Karpova, Margarita A. Eremina, Darya S. Pirozhkova, Nataly E. Gruntenko ARCH INSECT BIOCHEM, 2019, 101(1):e21540 |
|
| The effect of mild heat stress of different frequencies on the adaptability of Drosophila melanogaster females Burdina EV, Adonyeva NV, Karpova EK, Rauschenbach IY, Menshanov PN, Gruntenko NЕ. ARCH INSECT BIOCHEM, 2019, e21619. |
|
| Перспективы моделирования лекарственноиндуцированных гиперкинезов на Drosophila melanogaster Н.В. Адоньева, Е.А. Трифонова, Н.Е. Грунтенко Письма в Вавиловский журнал генетики и селекции, 2019, 2019;5(1):6-12 |
|
| 2018 | The role of insulin signalling in the endocrine stress response in Drosophila melanogaster: A mini-review N. Е. Gruntenko, I. Yu. Rauschenbach GEN COMP ENDOCR, 2018, V.258, P.134-139. |
| ВЛИЯНИЕ СТРЕСС-СВЯЗАННЫХ ГОРМОНОВ НА СТРЕССОУСТОЙЧИВОСТЬ Drosophila melanogaster С МУТАЦИЕЙ ГЕНА ИНСУЛИНОПОДОБНОГО БЕЛКА DILP6 Е. В. Бурдина*, Н. В. Адоньева, Н. Е. Грунтенко, И. Ю. Раушенбах RUSS J GENET+, 2018, том 54, №2, С.263-265 |
|
| ВЛИЯНИЕ ТЕПЛОВОГО СТРЕССА НА ЭКСПРЕССИЮ ГЕНОВ ИНСУЛИНОПОДОБНЫХ БЕЛКОВ DILP2 И DILP3 У ИМАГО Drosophila melanogaster О.В. Андреенкова, М.А. Еремина, Н.Е. Грунтенко, И.Ю. Раушенбах* RUSS J GENET+, 2018, том 54, №3, с.366–368 |
|
| ВЛИЯНИЕ ГОНАДОТРОПНЫХ ГОРМОНОВ НА СТРЕССОУСТОЙЧИВОСТЬ САМОК DROSOPHILA MELANOGASTER ИНФИЦИРОВАННЫХ РАЗНЫМИ ГЕНОТИПАМИ WOLBACHIA PIPIENTIS И.Ю. Раушенбах, Н.В. Адоньева, Е.К.Карпова, Ю.Ю.Илинский, Н.Е. Грунтенко RUSS J GENET+, 2018, Том 54, № 7, С.856-859 |
|
| Сравнительный анализ приспособленности
линий Drosophila virilis, контрастных по реакции
на стрессирующее воздействие Е.К. Карпова , И.Ю. Раушенбах, Н.Е. Грунтенко Vavilov journal of genetics and breeding, 2018, Т. 22, № 8 |
|
| 2017 | Insulin-like receptor substrate gene chico regulates octopamine metabolism in Drosophila melanogaster Natalya V. Adonyeva, Elena V. Burdina, Inga Yu. Rauschenbach, Petr N. Menshanov, Nataly E. Gruntenko PHYSIOL ENTOMOL, 2017, Volume 42, Issue 1, Pages 85–90 |
| Insulin-like peptide DILP6 regulates juvenile hormone and dopamine metabolism in Drosophila females. Rauschenbach IY, Karpova EK, Burdina EV, Adonyeva NV, Bykov RA, Ilinsky YY, Menshanov PN, Gruntenko NE GEN COMP ENDOCR, 2017, 243:1-9 |
|
| Получение меченного тритием ювенильного гормона и радиометрический анализ уровня его ферментативного гидролиза Романова И. В., Алексеев А.А., Рихтер В.А., Грунтенко Н.Е., Агафонцев А.М., Карпова Е.К. RUSS J BIOORG CHEM+, 2017, том 43, № 2, с. 208-213 |
|
| Гипоморфная мутация гена dilp6 повышает экспрессию DILP3 в инсулинпродуцирующих клетках Drosophila melanogaster О.В. Андреенкова, И.Ю. Раушенбах, Н.Е. Грунтенко RUSS J GENET+, 2017, том 53, № 10, C. 1232–1234. |
|
| Various Wolbachia genotypes differently influence host Drosophila dopamine metabolism and survival under heat stress conditions N.Е. Gruntenko, Y.Y. Ilinsky, N.V. Adonyeva, E.V. Burdina, R.A. Bykov, P.N. Menshanov, I.Yu. Rauschenbach BMC EVOL BIOL, 2017, 17(Suppl 2):252. DOI: 10.1186/s12862-017-1104-y |
|
| Molecular Mechanisms of Autism as a Form of Synaptic Dysfunction E. A. Trifonova, T. M. Khlebodarova, N. E. Gruntenko Russian Journal of Genetics: Applied Research, 2017, Vol. 7, No. 8, pp. 869–877 |
|
| Нейроэндокринная стресс-реакция насекомых: история развития концепции Еремина М.А., Грунтенко Н.Е. Vavilov journal of genetics and breeding, 2017, Т. 21. № 7. С. 825-832 |
|
| 2016 | Probable mechanism of sexual dimorphism in insulin control of Drosophila heat stress resistance NATALY E. GRUNTENKOa, EVGENIA K. KARPOVAa, ELENA V. BURDINAa, NATALYA V. ADONYEVAa, OLGA V. ANDREENKOVAa, ALEXANDER A. ALEKSEEVb and INGA YU. RAUSCHENBACHa PHYSIOL ENTOMOL, 2016, V. 41, # 1, P. 59–66. DOI: 10.1111/phen.12125 |
| Ген dilp6 регулирует метаболизм октопамина у Drosophila melanogaster Бурдина Е.В., Адоньева Н.В., Грунтенко Н.Е., Раушенбах И.Ю. RUSS J GENET+, 2016, т.52, №6, с 718-722 DOI: 10.1134/S1022795418020060 |
|
| МУТАЦИЯ ГЕНА chico ВЛИЯЕТ НА РАЗВИТИЕ НЕЙРОЭНДОКРИННОЙ СТРЕСС-РЕАКЦИИ У Drosophila Карпова Е.К., Раушенбах И.Ю., Бурдина Е.В., Грунтенко Н.Е. Doklady Biochemistry and Biophysics, 2016, т. 469 №2 c. 244-247 DOI: 10.7868/S0869565216200251 |
|
| Экспрессия гена инсулиноподобного рецептора в тканях, синтезирующих гонадотропные гормоны, при половом созревании самок Drosophila melanogaster О.В. Андреенкова, Н.В. Адоньева, М.А. Еремина, Н.Е. Грунтенко, И.Ю. Раушенбах RUSS J GENET+, 2016, т.52, №11, с.1342-1344 DOI: 10.1134/S1022795416110028 |
|
| The impact of FOXO on dopamine and octopamine metabolism in Drosophila under normal and heat stress conditions Gruntenko N.E., Adonyeva N.V., Burdina E.V., Karpova E.K., Andreenkova O.V., Gladkikh D.V., Ilinsky Y.Y., Rauschenbach I.Yu. Biology Open, 2016, V.5, N.11, P.1706-1711 doi: 10.1242/bio.022038 |
|
| 2015 | ТРАНСКРИПЦИОННЫЙ ФАКТОР dFOXO РЕГУЛИРУЕТ МЕТАБОЛИЗМ ЮВЕНИЛЬНОГО ГОРМОНА У САМОК Drosophila melanogaster И. Ю. Раушенбах, Е. К. Карпова, Н. Е. Грунтенко RUSS J GENET+, 2015, том 51, № 9, с. 1083–1086 |
| Нокдаун гена InR в вентральных нефроцитах повышает устойчивость самок Drosophila melanogaster к токсическому стрессу Андреенкова О.В., Карпова Е.К., Меньшанов П.Н., Раушенбах И.Ю. RUSS J GENET+, 2015, Т.51, №2, С.263-265 |
|
| Взаимодействие инсулинового и дофаминового сигнальных путей в контроле приспособленности Drosophila melanogaster Раушенбах И.Ю., Карпова Е.К.,Алексеев А.А., Адоньева Н.В., Шумная Л.В., Грунтенко Н.Е Doklady Biochemistry and Biophysics, 2015, Т.461, №6, С. 724-728 |
|
| 2014 | Экспрессия гена InR и метаболизм октопамина у самок Drosophila melanogaster Раушенбах И.Ю., Карпова Е.К., Адоньева Н.В., Грунтенко Н.Е. RUSS J GENET+, 2014, Т.50, №3, С.360–363 |
| Probable role of dopamine in the regulation of ventral nephrocyte functioning in Drosophila melanogaster adults Андреенкова О.В., Карпова Е.К., Грунтенко Н.Е. PHYSIOL ENTOMOL, 2014, V. 39, p. 28–32 |
|
| The disruption of insulin signaling affects neuroendocrine stress reaction in Drosophila females Rausсhenbaсh I.Yu., Karpova E.K., Adonyeva N.V., Andreenkova O.V., Faddeeva N.V., Burdina E.V., Alekseev A.A., Menshanov P.N., Gruntenko N.Е. J EXP BIOL, 2014, V.217, N.20, P.3733-3741. doi:10.1242/jeb.106815 |
|
| P-M hybrid dysgenesis affects juvenile hormone metabolism in Drosophila melanogaster females Zakharenko L.P., Karpova E.K., Rauschenbach I.Y. RUSS J GENET+, 2014, № 7, V. 50, P. 878–880 |
|
| 2013 | Повсеместное подавление экспрессии гена InR влияет на метаболизм стресс-связанных гормонов у самок Drosophila Бурдина (Богомолова) Елена Владимировна, Адоньева Наталья Васильевна, Карпова Евгения Константиновна, Грунтенко Наталия Евгеньевна, Раушенбах Инга Юрьевна RUSS J GENET+, 2013, Т.49, №7, С.778-781 |
| Влияние полового созревания на экспрессию гена DD2R в жировом теле самок Drosophila Андреенкова (Лаухина) Ольга Владимировна, Филипенко Елена Анатольевна, Раушенбах Инга Юрьевна RUSS J GENET+, 2013, Т.49, № 9, С.1124-1126 |
|
| Инсулин влияет на метаболизм дофамина у самок Drosophila в нормальных и стрессирующих условиях Адоньева Наталья Васильевна, Бурдина (Богомолова) Елена Владимировна, Раушенбах Инга Юрьевна, Грунтенко Наталия Евгеньевна Doklady Biochemistry and Biophysics, 2013, Т.448, №5, С.595-597 |
|
| Роль инсулинового сигнального пути в контроле полового диморфизма по устойчивости Drosophila к тепловому стрессу Раушенбах Инга Юрьевна, Адоньева Наталья Васильевна, Фаддеева Наталья Владимировна, Шумная Людмила Владимировна, Грунтенко Наталия Евгеньевна Doklady Biological Sciences, 2013, Т.452, №1, С.115–117 |
|
| Инсулин влияет на репродуктивную функцию и метаболизм ювенильного гормона у самок Drosophila в нормальных и стрессирующих условиях Карпова Е.К., Адоньева Н.В., Фаддеева Н.В., Романова И.В., Грунтенко Н.Е., Раушенбах И.Ю. Doklady Biochemistry and Biophysics, 2013, т.452, №6, с.677-680 |
|
| 2012 | Decrease in juvenile hormone level as a result of genetic ablation of the corpus allatum cells affects the synthesis and metabolism of stress related hormones in Drosophila. Gruntenko N.Е., Bogomolova E.V., Adonyeva N.V., Karpova E.K., Menshanov P.N., Alekseev A.A., Romanova I.V., Li S., Rauschenbach I.Yu. J INSECT PHYSIOL, 2012, V. 58. №.1. pp.49-55 |
| Downregulation of the dopamine 2-like receptor in corpus allatum affects juvenile hormone metabolism in Drosophila melanogaster females Gruntenko N.Е., Laukhina O.V., Bogomolova E.V., Karpova E.K., Menshanov P.N., Romanova I.V., Rauschenbach I.Yu. J INSECT PHYSIOL, 2012, 58: 348-355. |
|
| Уровень экспрессии гена DD2R в corpus allatum влияет на приспособленность самок Drosophila melanogaster Раушенбах И.Ю., Фаддеева Н.В., Лаухина О.В., Грунтенко Н.Е. RUSS J GENET+, 2012, т. 48, №6, с. 773-775 |
|
| Роль DopR-рецептора в молекулярном механизме дофаминовой регуляции метаболизма ювенильного гормона у самок Drosophila Карпова Е.К, Богомолова Е.В., Романова И.В., Грунтенко Н.Е., Раушенбах И.Ю. RUSS J GENET+, 2012, №8 т.48, 999-1002 |
|
| Dopamine Effect on 20-Hydroxyecdysone Level Is Mediated by Juvenile Hormone in Drosophila Females I. Yu. Rauschenbach, O. V. Laukhina, A. A. Alekseev, N. V. Adonyeva, E. V. Bogomolova, and N. E. Gruntenko Doklady Biochemistry and Biophysics, 2012, v.446, pp.131-133 |
|
| The Role of D1-Like Receptors in the Regulation of Juvenile Hormone Synthesis in Drosophila Females with Increased Dopamine Level I. Yu. Rauschenbach, E. V. Bogomolova, E. K. Karpova, L. V. Shumnaya, and N. E. Gruntenko Doklady Biochemistry and Biophysics, 2012, v.446, pp.131-134 |
|
| Role of D1- and D2-like receptors in age-specific regulation of juvenile hormone and 20-hydroxyecdysone levels by dopamine in Drosophila Gruntenko N.Е., Laukhina O.V., Rauschenbach I.Yu. J INSECT PHYSIOL, 2012, V.58, P.1534-1540 |
|
| 2011 | Mechanisms of age-specific regulation of dopamine metabolism by juvenile hormone and 20-hydroxyecdysone in Drosophila females. Rauschenbach I.Yu., Bogomolova E.V., Karpova E.K., Adonyeva N.V., Faddeeva N.V., Menshanov P.N., Gruntenko N.E. J COMP PHYSIOL B, 2011, V. 181, P. 19-26, doi: 10.1007/s00360-010-0512-8. |
| Подавление экспрессии гена DD2R в corpus allatum самок Drosophila melanogaster активирует щелочную фосфатазу. Богомолова Е.В., Адоньева Н.В., Фаддеева Н.В., Грунтенко Н.Е., Раушенбах И.Ю. RUSS J GENET+, 2011, Т.47, №4, С.557-559. |
|
| Decrease in juvenile hormone level as a result of genetic ablation of the Corpusallatum cells affects the synthesis and metabolism of stress related hormones in Drosophila Gruntenko N, Bogomolova EV, Adonyeva NV, Karpova EK, Menshanov PN, Alekseev AA, Romanova IV, Li S, Rauschenbach IY. J INSECT PHYSIOL, 2011, doi:10.1016/j.jinsphys.2011.09.015 |
|
| The Role of D2-Like Receptors in the Regulation of Juvenile Hormone Metabolism in Drosophila Females in Normal State and at Increased Dopamine Level E. K. Karpova, N. E. Gruntenko, L. V. Shumnaya, I. V. Romanova, and I. Yu. Rauschenbach Doklady Biochemistry and Biophysics, 2011, Т. 439. №1. С.155-157. |
|
| Половой диморфизм по гонадотропной функции ювенильного гормона у Drosophila Раушенбах И.Ю., Карпова Е.К., Фаддеева Н.В., Лаухина О.В., Грунтенко Н.Е. Doklady Akademii Nauk, 2011, Т. 441. №3. С.423-425 |
|
| Juvenile Hormone Synthesis Is Stimulated by Activation of Dopamine D1-Like Receptors in Drosophila I. Y. Rauschenbach, E. K. Karpova, E. V. Bogomolova, O. V. Laukhina, and N. E. Gruntenko Doklady Biochemistry and Biophysics, 2011, V.441.pp.273-275. |
|
| 2010 | Применение методов многомерной статистики для ранней диагностики лучших по росту популяций сосны в географических культурах Ефимов В.М., Тараканов В.В., Роговцев Р.В. Хвойные бореальной зоны, 2010, Том XXVII, № 1–2. С. 58–62. |
| Супрессия дофаминовых д2-подобных рецепторов активирует щелочную фосфатазу у Drosophila Богомолова Е.В., Адоньева Н.В., Шумная Л.В., Раушенбах И.Ю., Грунтенко Н.Е. Doklady Akademii Nauk, 2010, №2, Т.435, С. 275–277 |
|
| Dopamine down-regulates activity of alkaline phosphatase in Drosophila: the role of D2-Like receptors Bogomolova E.V., Rauschenbach I.Yu., Adonyeva N.V., Alekseev A.A., Faddeeva N.V., Gruntenko N.E. J INSECT PHYSIOL, 2010, V.56. P. 1155-1159 |
|
| Altered juvenile hormone metabolism, reproduction and stress response in Drosophila adults with genetic ablation of the corpus allatum cells Gruntenko N.Е.,Wen D., Karpova E.K., Adonyeva N.V., Liu Y., He Q., Faddeeva N.V., Fomin A.S., Li S., Rauschenbach I.Yu. INSECT BIOCHEM MOLEC, 2010, V.40, P.891-897 |
|
| SNPs in the HIV-1 and HIV-2 TATA Box and the AIDS pandemic Suslov V.V., Ponomarenko M.P., Savinkova L.K., Ponomarenko P.M., Efimov V.M., Kolchanov N.A. Journal of Bioinformatics and Computational Biology, 2010, 3, 8, 607-625. |
|
| The Effect of Dopamine on Alkaline Phosphatase Activity in Drosophila Is Mediated by D2-Like Receptors Bogomolova E. V., Rauschenbach I. Yu., Alekseev A. A., Faddeeva N. V., and Gruntenko N. E. Doklady Biochemistry and Biophysics, 2010, 431, 87-89 |
|
| Активация дофаминовых Д2-подобных рецепторов ингибирует деградацию ювенильного гормона у самок Drosophila Карпова Е.К., Раушенбах И.Ю., Шумная Л.В., Грунтенко Н.Е. Doklady Akademii Nauk, 2010, №1.Т.432.С.131-133 |
|
| Динамика направленной асимметрии билатеральных признаков в популяционном онтогенезе полевки-экономки В.Ю. Ковалева, В.М. Ефимов, Ю.Н. Литвинов. ZOOL ZH, 2010, том 89, № 9, с. 1139–1147. |
|
| 2009 | Effect of Gonadotropin on Dopamine Metabolism in Adult Drosophila Females Bogomolova E.V., Adonyeva N.V., Alekseev A.A., Gruntenko N.E., Rauschenbach I.Yu. Doklady Biochemistry and Biophysics, 2009, Т.427, С.179-181 |
| Effects of 20-hydroxyecdysone and juvenile hormone on octopamine metabolism in females of Drosophila Bogomolova E.V., Adonyeva N.V., Gruntenko N.Е. , Rauschenbach I.Yu. ARCH INSECT BIOCHEM, 2009, №4, V.70, P.244-253 |
|
| 20-hydroxyecdysone and juvenile hormone influence tyrosine hydroxylase activity in Drosophila females under normal and heat stress conditions Gruntenko N.Е., Karpova E.K., Chentsova N.A., Adonyeva N.V., Rauschenbach I.Yu ARCH INSECT BIOCHEM, 2009, №4, Т.72, P.263-272. |
|
| 2008 | Эпизоотический процесс бешенства: роль диких млекопитающих, периодичность Сидоров Г.Н., Сидорова Д.Г., Колычев Н.М., Ефимов В.М. Сибирский вестник сельскохозяйственной науки, 2008, № 12 |
| Влияние мутации apterous56f на активность N-ацетилтрансферазы и щелочной фосфатазы у самок D. melanogaster. Богомолова Е.В.,. Адоньева Н.В, Грунтенко Н.Е., Раушенбах И.Ю. RUSS J GENET+, 2008, Т.44. С. 710-712. |
|
| Gonadotropins Affect Tyrosine Decarboxylase Activity in Drosophila virilis E. V. Bogomolova, N. V. Adon’eva, N. E. Gruntenko, and I. Yu. Raushenbakh Doklady Biochemistry and Biophysics, 2008, №1, V.421, P.165-167 |
|
| Gonadotropins Regulate Tyrosine Hydroxylase Activity in Drosophila virilis E. K. Karpova, N. A. Chentsova, N. V. Adonyeva, A. A. Alekseev, L. V. Shumnaya, N. E. Gruntenko, and I. Yu. Rauschenbach Doklady Biochemistry and Biophysics, 2008, №1, V.423, P.325-327 |
|
| Interplay of juvenile hormone, 20-hydroxyecdisone and biogenic amines under normal and stress conditions and its effect on reproduction Gruntenko N.E., Rauschenbach I.Yu. J INSECT PHYSIOL, 2008, #6, V.54, P.902-908 |
|
| Physiological and Biochemical Distinctions between Solitary and Gregarious Caterpillars of the Meadow Moth Loxostege sticticalis L. (Lepidoptera: Pyralidae) A. A. Alekseev, V. V. Serebrov, O. N. Gerber, I. M. Dubovskii, V. V. Glupov, M. A. Ushakova, and I. Yu. Rauschenbach Doklady Biological Sciences, 2008, #2, V.422, P.316-317 |
|
| Role of arylalkylamine N-acetyltransferase in regulation of biogenic amines levels by gonadotropins in Drosophila Rauschenbach I.Yu., Adonyeva N.V., Alekseev A.A., Chentsova N.A., Gruntenko N.Е. J COMP PHYSIOL B, 2008, №3, V.178, P.315-320 |
|
| Role of ecdysone 20-monooxygenase in regulation of 20-hydroxyecdysone levels by juvenile hormone and biogenic amines in Drosophila Rauschenbach I.Yu., Gruntenko N.Е., Chentsova N.A., Adonyeva N.V., Alekseev A.A. J COMP PHYSIOL B, 2008, №1, V.178, P.27-32 |
|
| Нарушение функционирования соматических клеток в яйцевых камерах Drosophila melanogaster у мутантов по гену trithorax-like Огиенко А.А., Лаухина О.В., Васильев Г.В., Баричева Э.М. Информационный вестник ВОГИС, 2008, т.12, с. 399-405 |
|
| 2007 | Dopamine and octopamine regulate 20-hydroxyecdysone level in vivo in Drosophila Rauschenbach I.Yu., Chentsova N.A., Alekseev A.A., Gruntenko N.Е., Adonyeva N.V., Karpova E.K., Komarova T.N., Vasiliev V.G., Bownes M. ARCH INSECT BIOCHEM, 2007, V.65, №2, P.95-102 |
| Ecdysone 20-Monooxygenase Activity in Drosophila virilis Strains Varying in Ecdysteroid Response to Heat Stress N. A. Chentsova, N. E. Gruntenko, and I. Yu. Rauschenbach RUSS J GENET+, 2007, #7, V.43, P.829-830 |
|
| Effect of Biogenic Amines on Juvenile Hormone Metabolism in Male Drosophila under Normal Conditions and during Heat Stress I. Yu. Rauschenbach, E. K. Karpova, N. E. Gruntenko, L. V. Shumnaya, N. V. Faddeeva Doklady Biological Sciences, 2007, #1, V.413, P.118-120 |
|
| Effect of Octopamine on Ecdysone-20 Monooxygenase Activity in Drosophila N. A. Chentsova, A. A. Alekseev, N. E. Gruntenko, and I. Yu. Raushenbakh Doklady Biochemistry and Biophysics, 2007, #4, V.415, P.559-561 |
|
| Effects of Juvenile hormone and 20-hydroxyecdysone on alkaline phosphatase activity in Drosophila under normal and heat stress conditions Rauschenbach I.Yu., Bogomolova E.V., Gruntenko N.E., Adonyeva N.V., Chentsova N.A. J INSECT PHYSIOL, 2007, #6, V.53, P.587-591 |
|
| Effects of octopamine on juvenile hormone metabolism, dopamine and 20-hydroxyecdysone contents and reproduction in Drosophila Gruntenko N.E., Karpova E.K., Alekseev A.A., Chentsova N.A., Bogomolova E.V, Bownes M., Rauschenbach I.Yu. ARCH INSECT BIOCHEM, 2007, #2, V.65, P.85-94 |
|
| Нарушение баланса гонадотропинов снижает приспособленность Drosophila Раушенбах И.Ю., Грунтенко Н.Е., Адоньева Н.В., Шумная Л.В., Фаддеева Н.В. Doklady Akademii Nauk, 2007, Т.415. №1. С. 139-141. |
|
| Ювенильный гормон и 20-гидроксиэкдизон регулируют активность N-ацетилтрансферазы у Drosophila virilis. Адоньева Н.В.,Алексеев А.А., Грунтенко Н.Е.,Раушенбах И.Ю. Doklady Akademii Nauk, 2007, Т. 416. №2. С. 261-263. |
|
| Гонадотропины влияют на активность щелочной фосфатазы у Drosophila virilis Богомолова Е.В., Адоньева Н.В., Грунтенко Н.Е., Раушенбах И.Ю. Doklady Akademii Nauk, 2007, N.5, Т. 414, С. 134-136 |
|
| Biogenic Amines Regulate the Reproductive Function in Drosophila as Neurohormones I. Yu. Rauschenbach, E. K. Karpova, N. E. Gruntenko, Z. V. Saprykina, L. V. Shumnaya, and N. V. Faddeeva RUSS J DEV BIOL+, 2007, #1, V.38, P.42-47 |
|
| Changes in Juvenile Hormone Hydrolysis Rate and Dopamine Level in the Hemolymph of Galleria mellonella L. (Lepidoptera, Pyralidae) during Mycosis A. A. Alekseev, V. V. Serebrov, O. N. Gerber, M. A. Ushakova, T. N. Komarova, N. A. Chentsova, and I. Yu. Raushenbakh Doklady Biological Sciences, 2007, #5, V.412, P.58-60 |
|
| 2006 | Механизм влияния мутации apterous56f на репродуктивную функцию Drosophila melanogaster Раушенбах И.Ю., Н.Е. Грунтенко, Е.К. Карпова, Н.В. Адоньева, А.А. Алексеев, Н.А. Ченцова, Л.В. Шумная, Н.В. Фаддеева RUSS J GENET+, 2006, №2, Т.42, С.169-175 |
| Многомерный анализ и функциональная аннотация ДНК-чиповых профилей транскрипции генов, участвующих в адипогенезе Катохин А.В., Ефимов В.М., Бадратинов М.Ш., Камнева О. К., Мордвинов В.А. S AFR J CHEM-S-AFR T, 2006, т. 51, выпуск N7 |
|
| Октопамин регулирует уровень 20-гидроксиэкдизона у самок Drosophila Раушенбах И.Ю, Ченцова Н.А., Грунтенко Н.Е., Алексеев А.А.,Адоньева Н.В. Doklady Akademii Nauk, 2006, №1, Т.411, С.461-463 |
|
| Повышение уровня дофамина ускоряет половое созревание особей Drosophila melanogaster с дефицитом ювенильного гормона Грунтенко Н.Е., Карпова Е.К., Алексеев А.А., Н.А. Ченцова, Шумная Л.В., Ушакова М.А., Раушенбах И.Ю Doklady Akademii Nauk, 2006, №4, Т.406, С.561-563 |
|
| Пространственная организация сообществ животных: теоретические и эмпирические представления Равкин Ю.С., Ефимов В.М. ZOOL ZH, 2006, Т. 86. № 3. С. 1-14. |
|
| Роль генетических факторов в ландшафтно-географической изменчивости водяной полевки (Arvicola terrestris L.) Ковалева В.Ю., Ефимов В.М, Фалеев В.И, Галактионов Ю.К., Абрамов С.А., Назарова Г.Г., Музыка В.Ю., Епифанцева Л.Ю RUSS J ECOL+, 2006, №6. С. 469-474. |
|
| Rats with inherited stress-induced arterial hypertension (ISIAH strain) display specific quantitative trait loci for blood pressure and for body and kidney weight on chromosome 1 OE Redina, NA Machanova, VM Efimov and AL Markel CLIN EXP PHARMACOL P, 2006, V. 33. P. 456–464. |
|
| Влияние октопамина на репродуктивную функцию Drosophila melanogaster опосредуется гонадотропинами Раушенбах И.Ю., Грунтенко Н.Е., Карпова Е.К., Алексеев А.А., Ченцова Н.А. Doklady Akademii Nauk, 2006, №5, Т.410, С. 407-409 |
|
| Действие экзогенных экдистероидов на рост, развитие и плодовитость египетской хлопковой совки Spodoptera littoralis Boisd. (Lepidoptera: Noctuidae) Уфимцев Г.К., Ширшова Т.М., Володин В.В., Володина С.О.,Алексеев А.А., Раушенбах И.Ю. Doklady Akademii Nauk, 2006, №6, Т.411, С.512-514 |
|
| Дофамин влияет на уровень 20-гидроксиэкдизона у самок Drosophila virilis Раушенбах И.Ю., Ченцова Н.А., Алексеев А.А., Грунтенко Н.Е., Карпова Е.К. Doklady Akademii Nauk, 2006, Т.407. №5. С. 715-717 |
|
| 2005 | 20-гидроксиэкдизон взаимодействует с ювенильным гормоном и дофамином в контроле плодовитости Drosophila virilis Раушенбах И.Ю., Грунтенко Н.Е., Карпова Е.К., Адоньева Н.В., Алексеев А.А., Володин В.В. Doklady Akademii Nauk, 2005, Т. 400 С.847-849 |
| Экспериментальное снижение уровня дофамина драматически снижает приспособленность Drosophila virilis Грунтенко Н.Е., Карпова Е.К., Алексеев А.А., Фаддеева Н.В., Раушенбах И.Ю. Doklady Akademii Nauk, 2005, Т.401. С. 424-426 |
|
| Ген ecdysoneless1 регулирует метаболизм ювенильного гормона и дофамина у Drosophila melanogaster Карпова Е.К.,. Грунтенко Н.Е, Раушенбах И.Ю. Генетика, 2005, Т. 41. № 11 C. 1480-1486 |
|
| Juvenile hormone, 20-hydroxyecdysone and dopamine interaction in Drosophila virilis reproduction under normal and nutritional stress conditions Gruntenko N.E., Karpova E.K. , Adonyeva N.V., Chentsova N.A., Faddeeva N.V., Alekseev A.A.,. Rauschenbach I.Yu. J INSECT PHYSIOL, 2005, V.51. P.417-425 |
|
| Effects of dopamine on juvenile hormone metabolism and fitness in Drosophila virilis. Gruntenko N.E., Karpova E.K., Alekseev A.A., Chentsova N.A., Saprykina Z.V., Bownes M., Rauschenbach I.Yu. J INSECT PHYSIOL, 2005, V.51, 959-968 |
|
| 2004 | Наличие обратной связи в регуляции титра ювенильного гормона биогенными аминами у Drosophilidae Раушенбах И.Ю., Грунтенко Н.Е., Ченцова Н.А., Адоньева Н.В., Карпова Е.К. Doklady Akademii Nauk, 2004, т.397, №3, с.427-429 |
| The effect of mutations altering biogenic amine metabolism in Drosophila on viability and the response to heat stress Gruntenko N.Е., Chentsova N.A., Andreenkova (Burdina) E.V., Karpova E.K., Glazko G.V., Monastirioti M., Rauschenbach I.Yu. ARCH INSECT BIOCHEM, 2004, V.55, N.2, P.55-67 |
|
| Адаптивное значение генов, контролирующих уровень биогенных аминов Drosophila Грунтенко Н.Е., Раушенбах И.Ю. Генетика, 2004, Т. 40. № 7. 869-876 |
|
| The role of juvenile hormone in the control of reproductive function in Drosophila virilis under nutritional stress Raushenbach IY, Gruntenko NE, Bownes M, Adonieva NV, Terashima J, Karpova EK, Faddeeva NV, Chentsova NA. J INSECT PHYSIOL, 2004, v.50, p.323-330 |
|
| Ювенильный гормон контролирует процесс откладки яиц и плодовитость Drosophila virilis при голоде Раушенбах И.Ю., Адоньева Н.В., Грунтенко Н.Е., Карпова Е.К., Фаддеева Н.В. Онтогенез, 2004, Т. 35 №5, С. 366-371 |
|
| 2003 | Stress response in a juvenile hormone deficient Drosophila melanogaster mutant apterous56f Gruntenko N.Е., Chentsova N.A., Andreenkova (Burdina)E.V., Bownes M., Segal D., Adonyeva N.V., Rauschenbach I.Yu. INSECT MOL BIOL, 2003, V.12, р.353-363 |
| Heat stress affects oogenesis differently in wild type Drosophila virilis and a mutant with altered juvenile hormone and 20-hydroxyecdysone levels Gruntenko N.Е., Bownes M., Terashima J., Sukhanova M.Zh., Rauschenbach I.Yu. INSECT MOL BIOL, 2003, V.12, р.393-404 |
|
| Ювенильный гормон контролирует откладку яиц у Drosophila при тепловом стрессе Грунтенко Н.Е., Карпова Е.К., Раушенбах И.Ю. Doklady Akademii Nauk, 2003, Т.392, №2, С.1-3 |
|
| При стрессе экдистероиды контролируют ранние, а ювенильный гормон поздние стадии оогенеза у Drosophila Раушенбах И.Ю., Грунтенко Н.Е., Баунс М., Карпова Е.К., Ченцова Н.А., Суханова М.Ж., Адоньева Н.В. Doklady Akademii Nauk, 2003, T.389, №1, С.127-129 |
|
| Баланс аллелей, регулирующих базальный уровень дофамина у Drosophila, адаптивен для популяции Раушенбах И.Ю., Ченцова Н.А., Грунтенко Н.Е., Фаддеева Н.В., Богомолова (Бурдина) Е.В. Doklady Akademii Nauk, 2003, Т. 393, №6. С.1-5 |
|
| Гипотеза паразитарного стресса при заражении насекомых микроспоридиями Селезнев К.В., Раушенбах И.Ю. Паразитология, 2003, Т.37, С.316-320 |
|
| Патологические изменения насекомых вызываемые микроспоридиями и другими паразитами и их сходство с патологиями, возникающими под влиянием неблагоприятных условий внешней среды Селезнев К.В., Раушенбах И.Ю Паразитология, 2003, Т.37, 229-240. |
|
| 2002 | Stress response in Drosophila melanogaster strain inactive with decreased tyramine and octopamine content. Chentsova N.A., Gruntenko N.E., Andreenkova (Burdina) E.V., Adonyeva N.V., Rauschenbach I.Yu. J COMP PHYSIOL B, 2002, V.172, P.643-650 |
| Синтез и деградация ювенильного гормона у Drosophila находятся под общим контролем Раушенбах И.Ю., Адоньева Н.В., Грунтенко Н.Е., Карпова Е.К., Ченцова Н.А., Фаддеева Н.В. Doklady Akademii Nauk, 2002, т.386, с.136-138 |
|
| 2001 | Биогенные амины негативно регулируют активность синтезирующих их ферментов у имаго Drosophila Грунтенко Н.Е., Андреенкова (Бурдина) Е.В., Монастириоти М., Раушенбах И.Ю. Doklady Akademii Nauk, 2001, т.379, N.4, 567-569 |
| О некоторых закономерностях генетического контроля стресс-реакции Drosophila Раушенбах И.Ю., Грунтенко Н.Е., Васенкова И.А., Хлебодарова Т.М., Суханова М.Ж., Корочкин Л.И. Генетика, 2001, Т.37, N1, С.73-80 |
|
| Взаимодействие гормонов в контроле репродуктивной функции самок Drosophila в условиях стресса генетически детерминировано Раушенбах И.Ю., Грунтенко Н.Е., Ченцова Н.А., Хирашима А., Суханова М.Ж., Андреенкова (Бурдина) Е.В., Глазко Г.В. Генетика, 2001, т.37, N.9, 1243-1250 |
|
| Стресс-реактивность системы дофамина у имаго Drosophila virilis контролируется геном, сцепленным с хромосомой 6 Суханова М.Ж., Васенкова И.А., Гренбэк Л.Г., Грунтенко Н.Е., Хлебодарова Т.М., Раушенбах И.Ю. Цитология и генетика, 2001, N1, 61-64. |
|
| Биогенные амины контролируют метаболизм ювенильного гормона у имаго Drosophila melanogaster Грунтенко Н.Е., Монастириоти М., Раушенбах И.Ю. Doklady Akademii Nauk, 2001, Т.376, N.3, 427-429 |
|
| 2000 | Реакция теплового шока нарушена у неспособной к нейрогормональной стресс-реакции линии Drosophila virilis Васенкова И.А., Хлебодарова Т.М., Суханова М.Ж., Грунтенко Н.Е., Гренбэк Л.Г., Раушенбах И.Ю. Цитология и генетика, 2000, Т.34, N.3, C.43-48 |
| Роль системы экдистероидов в регуляции размножения Drosophila в стрессирующих условиях среды Раушенбах И.Ю., Суханова М.Ж., Хирашима А., Суцугу Е., Куано Е. Doklady Akademii Nauk, 2000, Т.375, N.4.С.1-3 |
|
| Stress-reactivity of a Drosophila melanogaster strain with impaired juvenile hormone action Gruntenko N.E., Khlebodarova T.M., Vasenkova I.A., Sukhanova M.Jh., Wilson T.G., Rauschenbach I.Yu. J INSECT PHYSIOL, 2000, V.46, P.451-456 |
|
| Stress-reactivity and juvenile hormone degradation in Drosophila melanogaster strains having stress-related mutations Gruntenko N.E., Wilson T.G., Monastirioti M., Rauschenbach I.Yu. INSECT BIOCHEM MOLEC, 2000, V.30, P.775-783 |
|
| Genetic control of biogenic amines system in Drosophila under normal and stress conditions Hirashima A., Sukhanova M. Jh., Rauschenbach I.Yu. BIOCHEM GENET, 2000, V.38(5-6), P.167-180 |
|
| Biogenic amines in Drosophila virilis under stress conditions. Hirashima A., M. Jh. Sukhanova and I. Yu. Rauschenbach BIOSCI BIOTECH BIOCH, 2000, V.64(12), P.2625-2630 |
|
| Ecdysteroids in stress responsive and nonresponsive Drosophila virilis lines under stress conditions. Hirashima A., Rauschenbach I.Yu., Sukhanova M.Jh. BIOSCI BIOTECH BIOCH, 2000, V.64(12), P.2657-2662 |
|
| The system of ecdisteroids is a componnt of the stress-reaction in Drosophila adults. Hirashima A., Rauschenbach I.Yu., Sukhanova M.Jh. DIS, 2000, V.83(7), P.4-5 |
|
| 1999 | Гены, регулирующие активность щелочной фосфатазы и тирозиндекарбоксилазы у Drosophila virilis сцеплены с хромосомой 6 Суханова М.Ж., Васенкова И.А., Гренбэк Л.Г., Грунтенко Н.Е., Хлебодарова Т.М., Раушенбах И.Ю. Генетика, 1999, т.35, с.50-54 |
| Prolonged negative selection of Drosophila melanogaster for a character of adaptive significance disturbs stress reactivity Gruntenko N.Е., Khlebodarova Т.М., Sukhanova М.Jh., Vasenkova I.А., Kaidanov L.Z., Rauschenbach I.Yu. Insect Biochem. Mol. Biol, 1999, V.29. – P. 445-452 |
|
| Нейрогенетика дрозофилы и проблемы нейробиологии. Е.И.Каракин, Н.В.Адоньева, Е.В.Савватеева-Попова, Л.З.Кайданов Vavilov journal of genetics and breeding, 1999, №9 |
|
| 1998 | Роль ювенильного гормона в контроле размножения насекомых Грунтенко Н.Е., Раушенбах И.Ю. Успехи современной биологии, 1998, T. 118. С.687-692 |
| Ген, контролирующий ответ системы деградации ЮГ у имаго Drosophila virilis на стрессирующее воздействие, сцеплен с хромосомой 6 Хлебодарова Т.М., Гренбэк Л.Г., Грунтенко Н.Е., Суханова М.Ж., Анкилова И.А., Шумная Л.В., Раушенбах И.Ю. Генетика, 1998, Т.34, С.625-628 |
|
| Селекция по половому поведению изменяет метаболизм ювенильного гормона у Drosophila melanogaster Грунтенко Н.Е., Хлебодарова Т.М., Анкилова И.А., Суханова М.Ж., Кайданов Л.З., Раушенбах И.Ю. Генетика, 1998, Т. 34. – С. 480-485 |
|
| Нарушения в стресс-реакции Drosophila коррелируют с изменениями в хит-шок ответе Хлебодарова Т.М., Анкилова И.А., Грунтенко Н.Е., Суханова М.Ж., Раушенбах И.Ю. Doklady Akademii Nauk, 1998, т. 361 |
|
| Система деградации ювенильного гормона не играет роли в репродуктивной функции самцов Drosophila melanogaster Грунтенко Н.Е. Хлебодарова Т.М. Анкилова И.А. Суханова М.Ж. Кайданов Л.З. Раушенбах И.Ю. Doklady Akademii Nauk, 1998, т.359 |
|
| Щелочная фосфатаза у линий Drosophila melanogaster, различающихся по половой активности самцов, и их F1-гибридов Суханова М.Ж. Анкилова И.А. Грунтенко Н.Е. Хлебодарова Т.М. Кайданов Л.З. Раушенбах И.Ю. Генетика, 1998, т.34 |
|
| Нарушение синтеза белков теплового шока не препятствует нормальному развитию стресс-реакции у Drosophila melanogaster Грунтенко Н.Е. Хлебодарова Т.М. Суханова М.Ж. Васенкова И.А. Раушенбах И.Ю. Doklady Akademii Nauk, 1998, т.362 |
|
| 1997 | Генетический контроль ответа системы метаболизма ЮГ Drosophila virilis на стрессирующие воздействия Гренбэк Л. Г., Хлебодарова Т. М., Грунтенко Н. Е., Суханова М. Ж., Шумная Л. В., Раушенбах И. Ю. Генетика, 1997, Т.33, С.202-204 |
| Генетический анализ различий активности дофадекарбоксилазы в двух линиях Drosophila virilis, отличающихся по содержанию дофамина Шумная Л.В., Суханова М.Ж., Грунтенко Н.Е., Гренбек Л.Г., Хлебодарова Т.М., Раушенбах И.Ю. Генетика, 1997, т.33, с.1-4 |
|
| Генетический контроль активности ДФФ-чувствительной эстеразы ювенильного гормона у D.virilis. Гренбэк Л.Г., Хлебодарова Т.М., Суханова М.Ж., Шумная Л.В., Грунтенко Н.Е., Анкилова А.А., Раушенбах И.Ю. Генетика, 1997, т.33, с.1-4 |
|
| Генетический контроль активности тирозиндекарбоксилазы Drosophila virilis Суханова М.Ж., Шумная Л.В., Гренбэк Л.Г., Грунтенко Н.Е., Хлебодарова Т.М., Раушенбах И.Ю. Генетика, 1997, т.33, с.1-5 |
|
| Tyrosine decarboxylase and dopa decarboxylase in Drosophila virilis under heat stress Sukhanova MJh, Shumnaya LV, Grenback LG, Gruntenko NE, Khlebodarova TM, Rauschenbach IYu. BIOCHEM GENET, 1997, v.35, p.91-103 |
|
| N-ацетилирование биогенных аминов у Drosophila virilis Суханова М.Ж., Хлебодарова Т.М., Гренбэк Л.Г., Грунтенко Н.Е., Шумная Л.В., Раушенбах И.Ю. Генетика, 1997, т.33, с.1-5 |
|
| Role of dopa decarboxylase and N-acetyltransferase in regulation of dopamine content in Drosophila virilis under normal and heat stress conditions. Rauschenbach IY, Sukhanova MZ, Shumnaya LV, Gruntenko N.E., Grenback L.G., Khlebodarova T.M., Сhentsova NA, INSECT BIOCHEM MOLEC, 1997, v.27, p.729-734 |
|
| Стресс-реакция насекомых: механизм и генетический контроль Раушенбах И.Ю. Генетика, 1997, т.33 |
|
| 1996 | Роль метаболизма ювенильного гормона в адаптации популяций Drosophila к стрессирующим условиям среды Грунтенко Н.Е., Хлебодарова Т.М., Мазуров М.М., Гренбэк Л.Г., Суханова М.Ж., Шумная Л.В., Захаров И.К., Хэммок Б.Д., Раушенбах И.Ю. Генетика, 1996, Т. 32. – С. 1191-1198 |
| The role of the degradation system of the juvenile hormone in the reproduction of Drosophila under stress Rauschenbach I.Yu., Gruntenko N.E., Khlebodarova T.M., Mazurov M.M., Grenback L.G., Sukhanova M.Jh., Shumnaja L.V., Zakharov I.K., Hammock B.D. J INSECT PHYSIOL, 1996, V. 42. – P. 735-742 |
|
| Ферменты метаболизма ювенильного гормона в онтогенезе Drosophila virilis Хлебодарова Т.М. Гренбэк Л.Г. Грунтенко Н.Е. Суханова М.Ж., Раушенбах И.Ю. Онтогенез, 1996, т.27, с.47-50 |
|
| Генетический контроль метаболизма ювенильного гормона у Drosophila melanogaster Грунтенко Н.Е., Хлебодарова Т.М., Гренбэк Л.Г., Суханова М.Ж., Захаров И.К., Раушенбах И.Ю. Генетика, 1996, т.32, с.1-4 |
|
| Alkaline phosphatase in Drosophila under heat stress Sukhanova, М.Jh., Grenback, L.G., Gruntenko, N.Е., Khlebodarova, Т.М., Rauschenbach, I.Yu. J INSECT PHYSIOL, 1996, v.42, p.161-165 |
|
| Генетический анализ различий в активности щелочной фосфатазы у двух линий Drosophila virilis, различающихся реакцией на тепловой стресс Суханова М.Ж., Гренбэк Л.Г., Грунтенко Н.Е., Хлебодарова Т.М., Раушенбах И.Ю. Генетика, 1996, т.32, с.1-4 |
|
| A comparative analysis of juvenile hormone metabolysing enzymes in two species of Drosophila during development. Khlebodarova, T.M., Gruntenko, N.E., Grenback, L.G., Sukhanova, M.Z., Mazurov, M.M., Tomas, B.A., Hammock, B.D., Rauschenbach, I.Y. INSECT BIOCHEM MOLEC, 1996, v.26, p.829-835 |
|
| Charactersitics of gastroprotein synthesis and phosphorylation in human gastric carcinoma cells E. I. Karakin, L. M. Nepomnyashchikh, K. V. Vardosanidze, Ya. Nekarda, Yu. I. Patyutko, G. I. Nepomnyashchikh, E. A. Suderevskii, V. V. Nechunaev, N. V. Adon'eva, S. V. Cheresiz, M. N. Bochkarev B EXP BIOL MED+, 1996, Volume 121, Issue 6, pp 610–614 |
|
| 1989 | Нейробелки p87 и nplmm Drosophila melanogaster дифференциально характеризуют самцов инбредных линий, различающихся по уровню половой и двигательной активности Каракин Е.И., Прасолова Н.В., Кайданов Л.З., Доклады АН СССР, 1989, Т. 307. – С. 1246-1249 |
 Монографии
Монографии
| 2025 | Жизнь в свете эволюции: 7-9-е классы: углубленный уровень: учебное пособие Бородин П.М., Абрашитов Ф.Л., Дерюженко М.А., Илинский Ю.Ю., Красников А.С., Косенко И.Н., Левинсон А.Л., Нетёсов С.В., Новиковская А.А., Пилипенко А.С., Посух О.В., Романенко М.В., Соловьёв В.И., Цыбко А.С., Цыганов М.А., Шоева О.Ю. |
| 2009 | 20-hydroxyecdysone, Juvenile Hormone and Biogenic Amines: Mechanisms of Interaction in Control of Drosophila Reproduction under Normal and Stressful Conditions Nataly Gruntenko, Inga Rauschenbach |
| 2008 | Стресс и размножение насекомых: гормональный контроль Грунтенко Н.Е. |
| 2000 | Biodiversity and dynamics of ecosystems in North Eurasia. Role of stress response in adaptation of individuals and populations (Drosophila model) Gruntenko N.E., Monastirioti M., Wilson T.G., Chentsova N.A., Sukhanova M.Zh., Rauschenbach I.Yu. |
| 1991 | Changes in ecdysteroid and juvenile hormone under heat stress. Rauschenbach I.Yu. |
| 1990 | Нейроэндокринная регуляция развития насекомых в условиях стресса Раушенбах И.Ю. |
 Конференции
Конференции
| 2025 | Штамм wMelPlus бактерии Wolbachia,внутриклеточный симбионт насекомых, повышающийустойчивость хозяина к высоким температурам Шишкина О.Д., Коренская А.Е. , Дерюженко М.А., Андреенкова О.В., Шацкая Н.В., Васильев Г.В., Бобровских М.А., Клименко А.И., Грунтенко Н.Е. Конгресс исследователей симбиотических систем (КИСС 2025) |
| Поиск новых эффективных пестицидов: изучение инсектицидной активности нового соединения из класса оксатиазепанов Н. Е. Грунтенко, Н. В. Адоньева, Е. К. Карпова, М. А. Дерюженко, К. С. Ковалева, O. И. Яровая V МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «СОВРЕМЕННЫЕ ПРОБЛЕМЫ ИММУНИТЕТА РАСТЕНИЙ К ВРЕДНЫМ ОРГАНИЗМАМ» |
|
| 2024 | Влияние эндосимбиотической бактерии Wolbachia на дифференциальную
экспрессию генов, метаболизм и поведение Drosophila melanogaster Н. Е. Грунтенко, М. А. Дерюженко, О. В. Андреенкова, О. Д. Шишкина, Е. К. Карпова, Е. В. Бурдина, М.А. Бобровских, Л. П. Захаренко, Г. В. Васильев, Н. В. Шацкая VIII Съезд Вавиловского общества генетиков и селекционеров, посвященный 300-летию российской науки и высшей школы |
| Влияние личиночного стресса и инфицирования Wolbachia на скорость
развития и приспособленность Drosophila melanogaster Н. В. Адоньева, Е. К. Карпова, В. М. Ефимов, Н. Е. Грунтенко VIII Съезд Вавиловского общества генетиков и селекционеров, посвященный 300-летию российской науки и высшей школы |
|
| Изменения в метаболизме имаго D.melanogaster, перенесших стресс
в личиночном возрасте Е. К. Карпова, М. А. Бобровских, Е. В. Бурдина, В. М. Ефимов, Н. Е. Грунтенко VIII Съезд Вавиловского общества генетиков и селекционеров, посвященный 300-летию российской науки и высшей школы |
|
| Анализ адаптационно‑значимого для хозяина штамма wMelPlus эндосимбиотической бактерии Wolbachia и его влияния на транскриптом Drosophila melanogaster О. Д. Шишкина, М. А. Дерюженко, О. В. Андреенкова, М. А. Бобровских, Н. В. Шацкая, Г. В. Васильев, А. И. Клименко, А. Е. Коренская, Н. Е. Грунтенко VIII Съезд Вавиловского общества генетиков и селекционеров, посвященный 300-летию российской науки и высшей школы |
|
| 2023 | Зачем мухам вольбахии, или Особенности влияния бактерии на метаболизм, дифференциальную экспрессию генов и образ жизни хозяина Грунтенко Н.Е., Андреенкова О.В., Шишкина О.Д., Шацкая Н.В., Дерюженко М.А., Карпова Е.К., М.А. Бобровских М.А., Захаренко Л.П., Адоньева Н.В. Всероссийская конференция с международным участием «Дрозофила 2023» |
| Влияние комбинаций генотипов эндосимбионта Wolbachia и хозяина Drosophila melanogaster на онтогенез, стрессоустойчивость и плодовитость последнего Адоньева Н.В., Ефимов В.М., Грунтенко Н.Е. Всероссийская конференция с международным участием «Дрозофила 2023» |
|
| Анализ штамма Wolbachia wMelPlus, повышающего
стрессоустойчивость Drosophila melanogaster Шишкина О.Д., Андреенкова О.В., Шацкая Н.В., Клименко А.И., Коренская А.Е., Грунтенко Н.Е. Всероссийская конференция с международным участием «Дрозофила 2023» |
|
| Влияние теплового стресса, перенесенного D. melanogaster в личиночном возрасте, на приспособленность имаго Е.К. Карпова, М.А. Бобровских, Е.В. Бурдина, В.М. Ефимов, Н.Е. Грунтенко Всероссийская конференция с международным участием «Дрозофила 2023» |
|
| 2022 | Воздействие атмосферного давления и инфицирования Wolbachia pipientis (Rickettsiales: Ehrchiaceae) на плодовитость Drosophila melanogaster (Diptera: Drosophilidae) Н.В. Адоньева, П.Н Меньшанов, Н.Е.Грунтенко XVI съезд Русского Энтомологического Общества |
| Genome assembly of a new Wolbachia pipientis strain:
a promising source for studying Drosophila melanogaster
endosymbiosis Klimenko A.I., Korenskaia A.E., Shishkina O.D., Andreenkova O.V., Shatskaya N.V., Vasiliev G.V., Gruntenko N.E. BGRS/SB-2022: 13th International Multiconference on “Bioinformatics of Genome Regulation and Structure/Systems Biology” |
|
| СРАВНИТЕЛЬНЫЙ ГЕНОМНЫЙ АНАЛИЗ ШТАММОВ WOLBACHIA PIPIENTIS, РАЗЛИЧАЮЩИХСЯ ПО ВЛИЯНИЮ НА СТРЕССОУСТОЙЧИВОСТЬ DROSOPHILA MELANOGASTER Шишкина О.Д., Андреенкова О.В., Клименко А.И., Коренская А.Е., Васильев Г.В., Шацкая Н.В., Грунтенко Н.Е. HSG-2022: III Всероссийская конференция "Высокопроизводительное секвенирование в геномике" |
|
| 2020 | Продолжительность жизни и плодовитость в условиях частых стрессов Н. Е. Грунтенко, Е. К. Карпова, О. В. Андреенкова, Е. В. Бурдина, Н. В. Адоньева, М. А. Еремина, П. Н. Меньшанов, И. Ю. Раушенбах МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ "ДРОЗОФИЛА В ГЕНЕТИКЕ И МЕДИЦИНЕ" |
| Адаптация методов количественного анализа содержания углеводов
и общих липидов для Drosophila melanogaster М. А. Еремина, Е. К. Карпова, Н. Е. Грунтенко МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ "ДРОЗОФИЛА В ГЕНЕТИКЕ И МЕДИЦИНЕ" |
|
| Исследование эффекта гормезиса при регулярном тепловом
стрессировании у двух видов Drosophila с использованием
нового автоматического метода изучения плодовитости Е. К. Карпова*, Е. Г. Комышев, М. А. Генаев, Н. В. Адоньева, М. А. Еремина, Н. Е. Грунтенко МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ "ДРОЗОФИЛА В ГЕНЕТИКЕ И МЕДИЦИНЕ" |
|
| Механизмы влияния Wolbachia на приспособленность
Drosophila melanogaster Н. В. Адоньева, Е. В. Бурдина, Ю. Ю. Илинский, Н. Е. Грунтенко МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ "ДРОЗОФИЛА В ГЕНЕТИКЕ И МЕДИЦИНЕ" |
|
| 2019 | ПРИСПОСОБЛЕННОСТЬ И ГОРМОНАЛЬНЫЙ СТАТУС DROSOPHILA MELANOGASTER ЗАВИСЯТ ОТ ГЕНОТИПА ЕЕ ЭНДОСИМБИОНТА WOLBACHIA PIPIENTIS Грунтенко Н.Е., Адоньева Н.В., Андреенкова О.В., Бурдина Е.В, Быков Р.А., Илинский Ю.Ю., Раушенбах И.Ю. VII съезд Вавиловского общества генетиков и селекционеров, посвященный 100-летию кафедры генетики СПбГУ, и ассоциированные симпозиумы. 18-22 июня 2019г, Санкт-Петербург. |
| РОЛЬ НЕЙРОГОРМОНАЛЬНОЙ СТРЕСС-РЕАКЦИИ В
ПРИСПОСОБЛЕННОСТИ DROSOPHILA VIRILIS Карпова Е.К. , Раушенбах И.Ю., Грунтенко Н.Е. VII Съезд ВОГиС |
|
| РОЛЬ ГЕНОВ ИНСУЛИНОВОГО СИГНАЛЬНОГО КАСКАДА DILP6 И
DFOXO В РЕГУЛЯЦИИ УГЛЕВОДНОГО И ЛИПИДНОГО
МЕТАБОЛИЗМА DROSOPHILA MELANOGASTER В УСЛОВИЯХ
ТЕПЛОВОГО СТРЕССА Еремина М.А. , Карпова Е.К., Грунтенко Н.Е. VII Съезд ВОГиС |
|
| 2018 | Effect of stress-related hormones on host Drosophila fitness
depends on endosymbiont Wolbachia genotype N. Adonyeva*, E. Burdina, N. Gruntenko, I. Rauschenbach BIODIVERSITY: GENOMICS AND EVOLUTION |
| Host Drosophila fitness and hormonal status depends
on the genotype of Wolbachia symbiont N.Е. Gruntenko*, N.V. Adonyeva, Y.Y. Ilinsky, E.V. Burdina, O.V. Andreenkova, R.A. Bykov, I.Yu. Rauschenbach Biodiversity: Genomics and Evolution (BioGenEvo-2018) |
|
| The hormonal mechanism of heat stress effect on the carbohydrate metabolism in Drosophila melanogaster females M.A. Eremina*, E.K. Karpova, N.E. Gruntenko 11-ая Международная конференция по биоинформатике регуляции и структуры геномов и системной биологии |
|
| ВЛИЯНИЕ СТРЕСС-СВЯЗАННЫХ ГОРМОНОВ НА УГЛЕВОДНЫЙ ОБМЕН ПРИ ТЕПЛОВОМ
СТРЕССЕ У САМОК DROSOPHILA MELANOGASTER Еремина М.А., Карпова Е.К., Грунтенко Н.Е. 22-я Международная пущинская школа-конференция молодых ученых «Биология – наука XXI века». |
|
| 2017 | Роль инсулинового сигнального пути в эндокринном стресс-ответе Drosophila melanogaster Н.Е.Грунтенко, И.Ю.Раушенбах Всероссийская конференция "Дрозофила в генетике и медицине" |
| Роль дофаминового и инсулинового сигнальных путей в регуляции функционирования вентральных нефроцитов имаго Drosophila melanogaster (Diptera: Drosophilidae) О.В.Андреенкова, Е.К.Карпова, И.Ю.Раушенбах, Н.Е.Грунтенко XV Съезд Русского Энтомологического Общества |
|
| The effect of endosymbiont Wolbachia pipientis (Rickettsiales: Rickettsiaceae) on dopamine metabolism of Drosophila melanogaster (Diptera: Drosophilidae) and its role in the control of heat stress resistance N.V. Adonyeva, I.Yu. Rauschenbach, Y.Y. Ilinsky, E.V. Burdina, R.A. Bykov, N.Е. Gruntenko XV Съезд Русского Энтомологического Общества |
|
| Влияние мутации гена инсулиноподобного белка Dilp6 на стрессоустойчивость самок Drosophila melanogaster (Diptera: Drosophilidae) опосредуется ювенильным гормоном Е.В.Бурдина, Н.В.Адоньева, Н.Е.Грунтенко, И.Ю.Раушенбах XV Съезд Русского Энтомологического Общества |
|
| The involvement of insulin signaling pathway in neurohormonal stress response N.Е. Gruntenko, I.Yu. Rauschenbach XV Съезд Русского Энтомологического Общества |
|
| Экспрессия гена инсулиноподобного рецептора в тканях, синтезирующих гонадотропные гормоны, в процессе полового созревания самок Drosophila melanogaster М.А.Еремина, О.В.Андреенкова, Н.В.Адоньева, Н.Е.Грунтенко, И.Ю.Раушенбах XV Съезд Русского Энтомологического Общества |
|
| Ген субстрата инсулиноподобного рецептора, chico, регулирует метаболизм октопамина у Drosophila melanogaster Н.В. Адоньева, Е.В. Бурдина, И.Ю. Раушенбах, Н.Е. Грунтенко BELYAEV CONFERENCE |
|
| The insulin-like receptor gene expression in tissues synthesizing gonadotropic hormones in Drosophila melanogaster female sexual maturation M.A. Eremina, O.V. Andreenkova, N.V. Adonyeva, N.E. Gruntenko, I.Yu. Rauschenbach BELYAEV CONFERENCE |
|
| Участие инсулинового сигнального пути в нейрогормональной стресс-реакции (на модели Drosophila melanogaster) Н.Е. Грунтенко, И.Ю. Раушенбах BELYAEV CONFERENCE |
|
| Получение меченного тритием ювенильного гормона и радиометрический анализ уровня его ферментативного гидролиза А.А. Алексеев, И.В. Романова, В.А. Рихтер, Н.Е. Грунтенко, Е.К. Карпова BELYAEV CONFERENCE |
|
| ЮВЕНИЛЬНЫЙ ГОРМОН И ДОФАМИН РЕГУЛИРУЮТ УРОВЕНЬ ТРЕГАЛОЗЫ У DROSOPHILA MELANOGASTER М.А. Еремина, Е.К. Карпова, Н.Е. Грунтенко 21-я Международная Пущинская школа-конференция молодых ученых «Биология – наука XXI века» |
|
| Получение меченного тритием ювенильного гормона и радиометрический анализ уровня его Ферментативного гидролиза. А.А. Алексеев, И.В. Романова, В.А. Рихтер, Н.Е. Грунтенко, Е.К. Карпова Международная конференция «Беляевские чтения», посвященная 100-летию академика АН СССР Д.К. Беляева |
|
| Роль ортолога субстрата инсулинового рецептора, CHICO, в регуляции приспособленности и гормонального статуса Drosophila в нормальных условиях и при стрессе. Адоньева Н. В., Карпова Е. К., Раушенбах И. Ю., Бурдина Е. В., Грунтенко Н. Е. Дрозофила в генетике и медицине |
|
| ВЛИЯНИЕ МУТАЦИЙ ГЕНОВ ИНСУЛИНОВОГО СИГНАЛЬНОГО ПУТИ НА УГЛЕВОДНЫЙ МЕТАБОЛИЗМ ПРИ ТЕПЛОВОМ СТРЕССЕ У САМОК DROSOPHILA MELANOGASTER Еремина М.А., Карпова Е.К., Грунтенко Н.Е. X Всероссийский с международным участием Конгресс молодых ученых-биологов "Симбиоз 2017" |
|
| 2016 | Stress response in Drosophila melanogaster: biogenic amines, juvenile hormone, 20-hydroxyecdysone and insulin signaling are involved. Nataly Gruntenko, Natalya Adonyeva, Olga Andreenkova, Elena Burdina, Evgenia Karpova, Inga Rauschenbach 28th Conference of European Comparative Endocrinologists. |
| 2015 | Dopamine interacts with juvenile hormone and insulin signaling pathways in the control of Drosophila stress resistance Gruntenko N., Rauschenbach I. 24th European Drosophila Research Conference, Heidelberg, Germany |
| 2014 | The role of insulin signaling pathway in the control of dopamine and juvenile hormone metabolism and stress response in Drosophila Gruntenko N.Е., Andreenkova O.V., Karpova E.K., Adonyeva N.V., Burdina E.V., Rauschenbach I.Yu. Xth European Congress of Entomology, York, UK |
| Нокдаун гена инсулиноподобного рецептора в железе, синтезирующей ювенильный гормон, влияет на метаболизм гормонов стресса и приспособленность Drosophila melanogaster. Раушенбах И.Ю., Адоньева Н.В., Андреенкова О.В., Бурдина Е.В., Карпова Е.К., Фаддеева Н.В., Грунтенко Н.Е. VI съезд ВОГИС и Ассоциированные генетические симпозиумы. |
|
| Дофамин регулирует функционирование вентральных нефроцитов имаго D. melanogaster: роль Д-1 и Д2-подобных рецепторов. Андреенкова О.В., Карпова Е.К., Грунтенко Н.Е. VI съезд ВОГИС и Ассоциированные генетические симпозиумы |
|
| Maternal inheritance of long-established Drosophila melanogaster stocks Yu. Ilinsky, R. Bikov, M. Judina, N. Weisman, L. Zakharenko, O. Ignatenko, N. Gruntenko, Karpova, I. Zakharov 8th International Wolbachia conference |
|
| 2012 | Влияние генетической абляции corpus allatum на развитие стресс-реакции у самок Drosophila melanogaster (Drosophilidae, Diptera) Богомолова Е.В., Грунтенко Н.Е., Адоньева Н.В., Карпова Е.К., Ли Ш., Раушенбах И.Ю. XIV съезд Российского энтомологического общества |
| Единый контроль синтеза и деградации ювенильного гормона у Drosophila melanogaster (Drosophilidae, Diptera) Карпова Е.К. Вен Д Лью У Ли Ш Грунтенко Н.Е. Раушенбах И.Ю. XIV съезд Российского энтомологического общества |
|
| Ингибирующее влияние дофамина на синтез ювенильного гормона у самок Drosophila melanogaster (Drosophilidae, Diptera) опосредуется D2-подобными рецепторами Адоньева Н.В., Лаухина О.В., Богомолова E.В.,Фаддеева Н.В., Грунтенко Н.Е., Раушенбах И.Ю. XIV съезд Российского энтомологического общества |
|
| Анализ экспрессии Д1- и Д2-подобных дофаминовых рецепторов в вентральных нефроцитах имаго Drosophila melanogaster (Drosophilidae, Diptera). Лаухина О.В., Грунтенко Н.Е. XIV съезд Российского энтомологического общества |
|
| Молекулярный механизм стадиеспецифической регуляции дофамином метаболизма ювенильного гормона у самок Drosophila. Грунтенко Н.Е. Лаухина О.В., Раушенбах И.Ю. XIV съезд Российского энтомологического общества |
|
| 2011 | Suppression of dopamine D2-like receptors in corpus allatum affects reproduction and stress response in Drosophila melanogaster females Laukhina O.V., Bogomolova E.V., Adonyeva N.V., Faddeeva N.V., Gruntenko N.Е., Rauschenbach I.Yu. The Third International Symposium on Insect Physiology, Biochemistry and Molecular Biology. Shanghai, China |
| Effects of suppression of DD2R gene in corpus allatum on juvenile hormone metabolism, reproduction and stress response in Drosophila melanogaster females Laukhina O.V., Bogomolova E.V., Karpova E.K., Gruntenko N.Е., Rauschenbach I.Yu. Sixth International Symposium on Molecular Insect Science. 2-5 October 2011. Amsterdam |
|
| Гормональные взаимодействия в контроле стресс реакции и размножения Грунтенко Н.Е., Раушенбах И.Ю. Международная Научная Конференция «Фундаментальные проблемы энтомологии в XXI веке». Ст.-Петербург, 16-20 мая 2011 |
|
| Количественные методы изучения гормонов и ферментов насекомых Алексеев А. А., Васильев В. Г., Карпова Е. К., Романова И. В., Рязанова А. Д., Шаталова Е. И. Международная научная конференция <Фундаментальные проблемы энтомологии в XXI веке>, Санкт-Петербург |
|
| Hormonal Interplay in the Control of Stress Response and Reproduction N.E. Gruntenko, I.Yu. Rauschenbach Sixth International Symposium on Molecular Insect Science. 2-5 October 2011. Amsterdam |
|
| 2010 | Reduction of gene net dynamic models using proper orthogonal decomposition V.M. Efimov, A.S. Novikov, A.A. Tikhonov, I.R. Akberdin, V.A. Likhoshvai 7th International conference on bioinformatics of genome regulation and structure\system biology (BGRS/SB'20010). June 20-27, 2010, Novosibirsk |
| Age-specific interactions of dopamine, 20-hydroxyecdysone and juvenile hormone in Drosophila: molecular mechanisms Gruntenko N., Bogomolova E., Karpova E., Adonyeva N. and Rauschenbach I. 18th International Ecdysone Workshop, Ceske Budejovice, Czech Republic |
|
| The transcriptional profile of retinal pigment epithelium/choroid of oxys rat as a background for the retinopathy development Anton Markovets. Kozhevnikova O.S. Efimov V.M., Kolosova N.G. 7th International conference on bioinformatics of genome regulation and structure\system biology (BGRS/SB'20010). June 20-27, 2010, Novosibirsk |
|
| Association Between Aggressive Behavior And Candidate Gene Polymorphisms: The Brain Serotonergic System In Pigs Terenina E., Bazovkina D., Efimov V., Rousseau S., Salin F., Monllor S., D’Eath R., Turner S., Kulikov A., Mormede P 9th World Congress on Genetics Applied to Livestock Production Leipzig, Germany, 2010 |
|
| SNPs in the hiv-1 TATA box and the aids pandemic V.V. Suslov, P.M. Ponomarenko, V.M. Efimov, M.P. Ponomarenko, L.K. Savinkova, N.A. Kolchanov Crimean meeting. IIIrd International conference, deducated to N.W. Timofeeff-Ressovsky "Modern problems of genetics, radiobiology, radioecology and evolution". Alushta, 9-14 october, 2010 |
|
| Подход и программные средства для описания макро- и микродинамики экосистем Тимонов В.С., Суслов В.В., Брянская А.В., Ефимов В.М., Колчанов Н.А. XIII Российская конференция с участием иностранных ученых "Распределенные информационные и вычислительные ресурсы"(DICR'2010). Новосибирск, ИВТ СО РАН, 30 ноября - 4 декабря 2010 г. № гос. регистрации 0321100051 |
|
| SNP ТАТА-бокса ВИЧ-1 и пандемия СПИД Суслов В.В., Пономаренко П.М., Пономаренко М.П., Ефимов В.М., Савинкова Л.К., Колчанов Н.А. Проблемы экологии. Чтения памяти проф. М.М.Кожова. Иркутск, 2010 |
|
| SNPs IN THE HIV-1 TATA BOX AND THE AIDS PANDEMIC V.V. Suslov, P.M. Ponomarenko, V.M. Efimov, M.P. Ponomarenko, L.K. Savinkova, N.A. Kolchanov (6) IIIrd International conference, deducated to N.W. Timofeeff-Ressovsky Crimean meeting."Modern problems of genetics, radiobiology, radioecology and evolution". |
|
| Molecular mechanisms of dopamine control of juvenile hormone titer in Drosophila Gruntenko N.E., Karpova E.K., Adonyeva N.V., Rauschenbach I.Yu. BGRS/SB’10, Novosibirsk |
|
| Bioinformatic analysis of rare single-nucleotide polymorphism combinations in the human genome. Yudin N.S., Ignatieva E.V., Efimov V.M. The Seventh International Conference on Bioinformatics of Genome Regulation and Structure \ Systems Biology (BGRS'2010) |
|
| Dopamine and octopamine regulate 20-hydroxyecdysone metabolism in vivo in Drosophila. Adonyeva N., Chentsova N., Alekseev A., Gruntenko N., Faddeeva N. and Rauschenbach I. 18th International Ecdysone Workshop , Ceske Budejovice, Czech Republic. |
|
| Developmental hormones controle dopamine metabolism in Drosophila females under normal and heat stress conditions. Karpova E.K., Bogomolova E.V., Adonyeva N.V., Shumnaya L.V., Gruntenko N.E. IXth European Congress of Entomology. Budapest, Hungary |
|
| Effects of 20-hydroxyecdysone and juvenile hormone on octopamine metabolism in females of Drosophila under normal and stress conditions. Bogomolova E.V., Adonyeva N.V., Chentsova N.A., Rauschenbach I.Yu. IXth European Congress of Entomology. Budapest, Hungary |
|
| Search for genetic loci associated with the manifestation of physiological characteristics of rats based on incomplete experimental data with the usage of artificial neural networks. Tikhonov A.A., Redina O.E., Efimov V.M., Markel A.L. The Seventh International Conference on Bioinformatics of Genome Regulation and Structure (BGRS 2010), Novosibirsk, Russia June 20-27, 2010. P 285. |
|
| 2009 | Молекулярные механизмы взаиморегуляции гонадотропинов и дофамина в контроле оогенеза Drosophila Грунтенко Н.Е., Ченцова Н.А., Богомолова Е.В., Адоньева Н.В., Карпова Е.К., Раушенбах И.Ю. 5-й съезд ВОГИС, посвященный 200-летию со дня рождения Чарльза Дарвина, Москва |
| Fitness is under dopamine and octopamine control in insects Gruntenko N.Е. IX East European Conference "Simpler Nervous Systems". St.Peterburg, 9-13 september, 2009 |
|
| Роль биогенных аминов в репродуктивной функции, выживаемости и контроле стресс-реакции имаго Drosophila. Богомолова Е.В., Раушенбах И.Ю. Вторые чтения, посвященные памяти В.И. Корогодина и В.А. Шевченко "Актуальные вопросы генетики, радиобиологии и радиоэкологии" |
|
| Octopamine as neurohormone regulates gonadotropins metabolism and reproductive function of Drosophila females Chentsova N.A., Karpova E.K., Gruntenko N.Е., Faddeeva N.V., Rauschenbach I.Yu IX East European Conference "Simpler Nervous Systems". St.Peterburg |
|
| Метаболизм ювенильного гормона у самок трансгенной линии D. melanogaster со сниженным уровнем D2-подобных рецепторов Карпова Е.К., Грунтенко Н.Е. V Съезд ВОГИС, Москва |
|
| Влияние мутаций, изменяющих уровень биогенных аминов на приспособленность Drosophila. Адоньева Н.В., Богомолова Е.В., Ченцова Н.А., Раушенбах И.Ю. V Съезд ВОГИС, Москва |
|
| Влияние нуль-мутации гена тирамин-гидроксилазы на метаболизм ювенильного гормона и 20-гидроксиэкдизона у Drosophila. Богомолова Е.В., Грунтенко Н.Е., Адоньева Н.В., Ченцова Н.А., Раушенбах И.Ю. V Съезд ВОГИС, Москва |
|
| Effects of gonadotropins on octopamine metabolism in Drosophila females. Adonyeva N.V., Bogomolova E.V, Gruntenko N.Е., Rauschenbach I.Yu. IX East European Conference "Simpler Nervous Systems". St.Peterburg |
|
| 2008 | The mechanisms of 20-hydrohyecdysone and dopamine interaction in Drosophila under normal and stress conditions Gruntenko N.Е., Chentsova N.A., Bogomolova E.V, Adonyeva N.V., Karpova E.K., Rauschenbach I.Yu. 17th Internetional Ecdysone Workshop, Ulm, Germany |
| Исследование влияния мутаций гена Trithorax-like на расхождение Х-хромосом в мейозе самок Drosophila melanogaster Лаухина О.В., Федорова С.А., Баричева Э.М. I Международная конференция "Дрозофила в экспериментальной генетике и биологии" |
|
| Эффективность экспрессии генов как функция их нуклеотидного состава Матушкин Ю.Г., Лихошвай В.А., Ефимов В.М., Вишневский О.В. II-ая Международная конференция "Математическая биология и биоинформатика" г. Пущино Московской области 7-13 сентября 2008 г. |
|
| Применение многомерного неметрического шкалирования в экологических исследованиях В.М.Ефимов, В.Ю.Ковалева Всероссийская конференция "Актуальные проблемы строительной отрасли" (8-10 апреля 2008, НГАСУ (Сибстрин), Новосибирск). – Новосибирск: НГАСУ (Сибстрин) |
|
| Механизм поддержания баланса гонадотропинов в контроле размножения дрозофилы. Адоньева Н.В., Ченцова Н.А., Грунтенко Н.Е., Карпова Е.К., Раушенбах И.Ю. VI Сибирский физиологический съезд, г. Барнаул |
|
| The mutual influence of 20-hydroxyecdysone and octopamine on the one another metabolism in Drosophila under normal and stress conditions. Bogomolova E.V., Adonieva N.V., Chentsova N.A., Gruntenko N.Е., Rauschenbach I.Yu. 17th Internetional Ecdysone Workshop, Ulm, Germany. |
|
| 2007 | Interplay of stress-related hormones in the control of insect fitness Gruntenko N.E., Chentsova N.A., Adonyeva N.V., Karpova E.K., Bogomolova E.V., Rauschenbach I.Yu 2nd World conference of stress. August 2007. Budapest, Hungary |
| Stress as a factor maintaining polymorphism of genes regulating the levels of stress-related hormones Rauschenbach I.Yu., Gruntenko N.E., Bogomolova E.V., Chentsova N.A. Current Evolutionary Thinking in Biology, Medicine and Sociology. International Conference Dedicated to 90 Anniversary of Prof. Dmitry K. Belyaev 7-9 August 2007, Novosibirsk, Russia |
|
| Стресс - как фактор, сохраняющий полиморфизм популяций по генам, регулирующим уровень стресс-связанных гормонов Раушенбах И.Ю., Грунтенко Н.Е., Богомолова Е.В., Ченцова Н.А. Current Evolutionary Thinking in Biology, Medicine and Sociology. International Conference Dedicated to 90 Anniversary of Prof. Dmitry K. Belyaev 7-9 August 2007, Novosibirsk, Russia |
|
| Анализ поведения серых крыс: эффекты отбора по оборонительным реакциям на человека и перекрестного воспитания И.З. Плюснина, В.М. Ефимов. Current Evolutionary Thinking in Biology, Medicine and Sociology. International Conference Dedicated to 90 Anniversary of Prof. Dmitry K. Belyaev 7-9 August 2007, Novosibirsk, Russia |
|
| Идентификация высоко наследуемых "химических" признаков-компонент в популяции сосны Ефимов В.М, Тараканов В.В, Наумова Н.Б, Ковалева В.Ю., Куценогий К.П, Макарикова Р.П, Чанкина О.В. Первое Международное совещание по сохранению лесных генетических ресурсов в Сибири (30 июля – 4 августа 2007, Барнаул, Россия). |
|
| The mechanisms of maintenance of juvenile hormone and 20-hydroxyecdysone balance in Drosophila females Gruntenko N.E., Chentsova N.A., Adonyeva N.V., Karpova E.K., Bownes M., Rauschenbach I.Yu. IX International conference on juvenile hormones, August 2007, York, UK |
|
| Механизм взаимодействия октопамина и гонадотропинов в контроле размножения насекомых в нормальных и стрессирующих условиях среды (модель Drosophila) Карпова Е.К., Ченцова Н.А., Фаддеева Н.В., Раушенбах И.Ю. V Конференция молодых ученых, посвященная М.А. Лаврентьеву |
|
| Механизм взаиморегуляции стресс-связанных гормонов насекомых в контроле репродуктивной функции в нормальных и стрессирующих условиях Грунтенко Н.Е., Ченцова Н.А., Карпова Е.К., Адоньева Н.В., Раушенбах И.Ю. Current Evolutionary Thinking in Biology, Medicine and Sociology, Internetional Conference Dedicated to 90-th Anniversary of Prof. Dmitry K.Belyaev |
|
| 2006 | 20-hydroxyecdysone, juvenile hormone and reproduction in Drosophila virilis under nutritional stress Chentsova N.A., Gruntenko N.E., Karpova E.K., Adonyeva N.V., Bownes M., Rauschenbach I.Yu. 16th Internetional Ecdysone Workshop, 10-14 July 2006, Gent University, Belgium. |
| Biogenic amines act as intermediary between juvenile hormone and 20-hydroxyecdysone in the control of drosophila reproduction Gruntenko N.E., Chentsova N.A., Karpova E.K., Alekseev A.A., Komarova T.N., Rauschenbach I.Yu. 16th Internetional Ecdysone Workshop, 10-14 July 2006, Gent University, Belgium |
|
| Interpretation of results of som analysis of microarray data by principal components Efimov V.M., Badratinov M.S., Katokhin A.V. 5th International Conference on Bioinformatics of Genome Regulation and Structure (BGRS'2006), Novosibirsk, Russia (July 14-22) |
|
| Ответ репродуктивной системы Drosophila на голодовой стресс Адоньева Н.В., Карпова Е.К., Грунтенко Н.Е. XIII Международное совещание и VI школа по эволюционной физиологии. Санкт-Петербург. 2006 |
|
| Генетические факторы краниометрической изменчивости природной популяции полевки-экономки (Microtus oeconomus) Ковалева В.Ю., Ефимов В.М. Популяционная экология животных / Мат. межд. конф. "Проблемы популяционной экологии животных", посв. пам. И.А.Шилова. –Томск: ТГУ |
|
| EPI-GIS: GIS assisted computer tools for data accumulation, computer analysis and modeling in molecular epidemiology Kolchanov N.A., Orlova G.V., Bachinsky A.G., Bazhan S.I., Shvarts Ya.Sh., Golomolzin V.V., Popov D.Yu., Efimov V.M., Tololo I.V., Ananko E.A., Podkolodnaya O.A., Il’ina E.N., Rogov S.I., Tretiakov V.E., Kubanova A.A., Govorun V.M. 5th International Conference on Bioinformatics of Genome Regulation and Structure (BGRS'2006), Novosibirsk, Russia (July 14-22) |
|
| Роль экдистероидов и ювенильного гормона в развитии стресс-реакции у Drosophila melanogaster Карпова Е.К., Ченцова Н.А., Грунтенко Н.Е., Раушенбах И.Ю. XIII Международное совещание и VI школа по эволюционной физиологии |
|
| Роль базального уровня биогенных аминов в адаптации Drosophilidae к стрессирующим условиям различной природы Богомолова Е.В., Ченцова Н.А., Грунтенко Н.Е., Раушенбах И.Ю. XIII Международное совещание и VI школа по эволюционной физиологии |
|
| Гормональный контроль репродукции насекомых в условиях стресса Грунтенко Н.Е., Раушенбах И.Ю. XIII Международное совещание и VI школа по эволюционной физиологии. |
|
| 2004 | Мутация, вызывающая дефицит ювенильного гормона, резко снижает приспособленность самок, но не самцов Drosophila Грунтенко Н.Е., Ченцова Н.А., Богомолова (Бурдина) Е.В., Адоньева Н.В., Раушенбах И.Ю. III съезд ВОГИС |
| Влияние теплового и голодового стресса на плодовитость линий Drosophila virilis дикого типа и с мутацией, нарушающей ответ системы ювенильного гормона на тепловой стресс Адоньева Н.В., Грунтенко Н.Е., Карпова Е.К., Фаддеева Н.В., Раушенбах И.Ю. III съезд ВОГИС |
|
| Взаимодействие ювенильного гормона и 20-гидроксиэкдизона в контроле оогенеза Drosophila в норме и при стрессе генетически детерминировано Раушенбах И.Ю., Грунтенко Н.Е., Баунс М., Адоньева Н.В., Карпова Е.К. III съезд ВОГИС |
|
| Juvenile hormone in the control of reproductive function in Drosophila virilis under stress Gruntenko N.E., Bownes M., Adonyeva N.V., Terashima J., Karpova E.K., Rauschenbach I.Yu. Eighth International Conference on the Juvenile Hormones |
|
| 2003 | The effect of starvation on juvenile hormone metabolism and reproduction in Drosophila virilis Adonyeva N.V., Gruntenko N.E., Karpova E.R., Faddeeva N.V., Rauschenbach I.Yu. 18th European Drosophila Research Conference |
| Juvenile hormone deficiency affects dopamine levels and adaptability in Drosophila melanogaster females but not males Chentsova N.A., Gruntenko N.E., Adonyeva N.V., Segal. D., Bownes M., Rauschenbach I.Yu. 18th European Drosophila Research Conference |
|
| Juvenile hormone and 20-hydroxyecdysone in Drosophila virilis oogenesis under heat stress Gruntenko N.E., Bownes M., Terashima J., Sukhanova M.Jh., Adonyeva N.V., Rauschenbach I.Yu. 18th European Drosophila Research Conference |
|
| 2002 | Ecdysteroid levels and oogenesis in Drosophila virilis under environmental stresses Gruntenko, N.E., Bownes M., Terashima J., Hirashima A., Sukhanova, M.Jh., Rauschenbach, I.Yu. XV International Ecdysone Workshop |
| Влияние экзогенного ювенильного гормона на плодовитость и уровень его метаболизма in vivo у линий Drosophila virilis, контрастно различающихся по этим параметрам Адоньева Н.В., Грунтенко Н.Е., Фаддеева Н.В., Ченцова Н.А., Карпова Е.К., Раушенбах И.Ю. Эндокринная регуляция физиологических функций в |
|
| Гормональный контроль вителлогенеза Drosophila virilis в стрессирующих условиях среды Грунтенко Н.Е., Баунс М., Карпова Е.К., Суханова М.Ж., Раушенбах И.Ю Эндокринная регуляция физиологических функций в норме и патологии |
|
| Дефицит ювенильного гормона влияет на развитие стресс-реакции у самок Drosophila melanogaster Ченцова Н.А., Грунтенко Н.Е., Богомолова (Бурдина) Е.В., Баунс М., Сегал Д., Раушенбах И.Ю. Эндокринная регуляция физиологических функций в норме и патологии |
|
| 2001 | Hormones interrelationship in the control of Drosophila female reproductive funktion under stress conditions. Gruntenko N.E., Chentsova N.A., Andreenkova (Burdina) E.V., Sukhanova M.Zh., Hirashuma A., Rauschenbach I.Yu 17th European Drosophila Research Conference |
| Role of dopamine in adaptation of drosophila adults to unfavorable conditions Chentsova N.A., Gruntenko N.E., Monastirioti M., Rauschenbach I.Yu. IVth European Workshop of Invertebrate Ecophysiology |
|
| Hormones interrelationship in the control of Drosophila reproduction under unfavourable environmental conditions Gruntenko N.E., Chentsova N.A., Sukhanova M.Zh., Hirashuma A., Rauschenbach I.Yu. IVth European Workshop of Invertebrate Ecophysiology |
 Гранты
Гранты
| 2025 | Поиск, изучение молекулярно-генетических механизмов действия и экспериментальная проверка эффективности новых малотоксичных для человека инсектицидов для агропромышленного комплекса РНФ, номер гранта 25-14-20014 |
| 2023 | Метаморфоз и стресс: страдают ли насекомые от детских
травм? РНФ, номер гранта 23-24-00320 |
| 2021 | Исследование возможного механизма регуляции
стрессоустойчивости насекомых внутриклеточным
симбионтом на модели Wolbachia pipientis - Drosophila
melanogaster РНФ, номер гранта 21-14-00090 |
| 2019 | Влияние частых стрессов на репродуктивную функцию насекомых: молекулярно-генетические механизмы РФФИ, номер гранта 19-04-00458-а |
| 2016 | Исследование роли эндосимбиоза в формировании приспособленности организма-хозяина на модели Wolbachia pipientis - Drosophila melanogaster РФФИ, номер гранта 16-04-00060 |
| 2015 | Инсулин и стресс: может ли стресс провоцировать развитие диабета 2 типа (D. melanogaster в качестве модели)? РФФИ, номер гранта 15-04-02934 |
| 2013 | Роль инсулинового сигнального пути в эндокринной регуляции репродуктивной функции насекомых (модель Drosophila) РФФИ, номер гранта 13-04-00019 |
| Взаимодействие октопаминового и инсулинового сигнальных путей в контроле репродуктивной функции насекомых президиум РАН (Программа "Живая природа: современное исостояние и проблемы развития"", номер гранта 30/37 |
|
| 2012 | Взаимодействия инсулиноподобных факторов роста со стресс-связанными гормонами насекомых в контроле приспособленности РФФИ, номер гранта 12-04-00065 |
| 2010 | Молекулярные механизмы стресс-специфического контроля экспрессии генов животных Министерство образования и науки Российской Федерации, номер гранта 02.740.11. 0705 |
| Идентификация генов-мишеней транскрипционных факторов, участвующих в контроле развития глаза дрозофилы РФФИ, номер гранта 10-04-01011 |
|
| Молекулярные механизмы регуляции метаболизма ювенильного гормона в процессе размножения насекомых (модель Drosophila) РФФИ, номер гранта №10-04-00172 |
|
| Роль дофамина в эволюционно-консервативных механизмах молекулярно-генетического контроля стрессоустойчивости у животных Министерства Науки и Образования РФ, номер гранта № НК-П324 |
|
| 2009 | Роль Д1- и Д2-подобных рецепторов в регуляции дофамином уровня стресс-связанных гормонов насекомых РФФИ, номер гранта №09-04-00441 |
| Молекулярно-генетические механизмы взаимодействия гонадотропинов и биогенных аминов в контроле оогенеза насекомых Программы Президиума РАН «Биологическое разнообразие», номер гранта № 23.25/4 |
|
| Молекулярные механизмы гормональной регуляции численности насекомых в нормальных и неблагоприятных условиях среды Программы Президиума СО РАН «Фундаментальные исследования, выполняемые совместно с академией наук Китая», номер гранта № 27 |
|
| Молекулярные механизмы регуляции уровня стресс-связанных гормонов насекомых Фонд Президента РФ для поддержки молодых ученых, номер гранта № МК-4180.2009.4 |
|
| 2007 | Исследование механизмов взаимодействия гонадотропинов и биогенных аминов в контроле размножения насекомых РФФИ, номер гранта №07-04-00194 |
| 2006 | МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ ОКТОПАМИНА И ГОНАДОТРОПИНОВ В КОНТРОЛЕ РАЗМНОЖЕНИЯ НАСЕКОМЫХ В НОРМАЛЬНЫХ И СТРЕССИРУЮЩИХ УСЛОВИЯХ СРЕДЫ (МОДЕЛЬ DROSOPHILA) президиум СО РАН, номер гранта №107 |
| Молекулярные механизмы взаимодействия стресс-связанных гормонов в контроле приспособляемости насекомых к неблагоприятным условиям среды РФФИ, номер гранта №06-04-48357 |
|
| 2004 | Механизмы регуляции экдистероидами репродуктивной функции Drosophilidae в неблагоприятных условиях различной природы РФФИ, номер гранта №04-04-48273 |
| 2003 | Роль мутационных и стрессорных изменений гормонального фона Drosophila в контроле репродуктивной функции Президент РФ, номер гранта № МК-185.2003.04 |
| 2001 | ENZYMES OF PHEROMONE BIOSYNTHESIS: IDENTIFICATION, REGULATION, EVOLUTION AND GENETICS The International Association for the Promotion of Co-operation with Scientists from the New Independent States of the Former Soviet Union, номер гранта Grant # YSF 2001/1-0010 |
| Закономерности гормонального контроля оогенеза Drosophila в норме и при стрессе РФФИ, номер гранта 01-04-48905 |
|
| 2000 | РОЛЬ СТРЕСС-РЕАКЦИИ В АДАПТАЦИИ ИНДИВИДУУМОВ И ПОПУЛЯЦИЙ (МОДЕЛЬ DROSOPHILA). Президиум РАН, номер гранта Проект N 278 |
| Экспериментальный поиск ключевого звена стресс-реакции (модель Drosophila) РФФИ, номер гранта 00-04-49-543 |
|
| 1997 | Закономерности экспрессии генных систем, контролирующих стресс-реакцию (модель Drosophila) РФФИ, номер гранта 97-04-49384 |
 Научное руководство
Научное руководство
| 2024 | Анализ генома штамма wMelPlus эндосимбиотической бактерии насекомых Wolbachia pipientis Шишкина Ольга Дмитриевна , 2024-04-03 |
| 2021 | Влияние кратковременного теплового стресса на экспрессию генов инсулинового сигнального каскада и углеводно-жировой обмен у Drosophila melanogaster Бобровских Маргарита Александровна , 2021-11-17 |
| 2008 | Роль экдистероидов в развитии стресс-реакции и контроле репродуктивной функции Drosophila в неблагоприятных условиях Карпова Евгения Константиновна , 2008-04-30 |
| Взаимодействие гонадотропинов и биогенных аминов в контроле адаптации имаго дрозофилы к стрессирующим условиям (генетико-физиологические аспекты) Грунтенко Наталия Евгеньевна , 2008-04-23 |
|
| 2006 | Влияние октопамина на метаболизм ювенильного гормона и репродуктивную функцию дрозофилы Сапрыкина Зоя Викторовна , 2006-06-06 |
| 2005 | Роль биогенных аминов в адаптации и контроле стресс-реакции имаго Drosophila (генетико-физиологические аспекты) Богомолова (Бурдина) Елена Владимировна , 2005-03-25 |
| Ювенильный гормон и биогенные амины в регуляции размножения и развития стресс-реакции Drosophila melanogaster (генетико-физиологические аспекты) Ченцова Надежда Алексеевна , 2005-01-19 |
|
| 2000 | Анализ взаимосвязи клеточного и нейроэндокринного ответов на стресс у Drosophila Васенкова Ирина Александровна , 2000-11-28 |
| 1998 | Закономерности генетического контроля метаболизма биогенных аминов у Drosophila в нормальных и стрессирующих условиях среды Суханова Мадина Жантасовна , 1998-03-04 |
| 1996 | Контроль деградации ювенильного гормона у имаго Drosophila virilis в норме и при тепловом стрессе. Генетико-биохимические аспекты Гренбэк Лариса Георгиевна , 1996-12-11 |
| Контроль деградации ювенильного гормона у имаго Drosophila virilis в норме и при тепловом стрессе. Генетико-биохимические аспекты. Гренбэк Лариса Георгиевна , 1996-12-11 |
|
| Метаболизм дофамина у Drosophila virilis в нормальных и стрессирующих условиях Среды. Генетико-биохимические аспекты Шумная Людмила Владимировна , 1996-10-16 |
|
| Роль системы деградации ювенильного гормона в стресс-реакции имаго и адаптации популяций Drosophila к неблагоприятным условиям среды Грунтенко Наталия Евгеньевна , 1996-10-16 |
 Учебные курсы
Учебные курсы
| 2011 | Многомерный анализ биологических данных Томский государственный университет, кафедра зоологии позвоночных и экологии, семестров: 1 |
 Патенты
Патенты
| 2008 | Программный пакет анализа портрета личности P-analyzer Мигинский Д.С., Завьялов В.Ю., Ефимов В.М., Тимонов В.С., Сурнина Н.Ю. Номер патента 2008611605 |
| © 2010-2026 ИЦиГ СО РАН. Все права защищены. |