Система учета научной деятельности (ASSA) |


|
Сектор генетических коллекций нейропатологий (т.80)Лаборатория генетики лабораторных животных (т.55)
Научные результаты Сотрудники О Подразделении 1. Основное направление фундаментальных и фундаментально-ориентированных исследований Изучение генетико-молекулярных механизмов распространенных наследственных патологий человека и способов их фармакологической коррекции с помощью их генетического моделирования на лабораторных животных.
2. Задачи, решаемые в настоящее время в рамках базового бюджетного проекта Бюджетные проекты № VI.53.2.1. «Иммуногенетические механизмы межорганизменных взаимодействий в репродуктивном цикле млекопитающих как фактор изменчивости потомков» (Мошкин М.П.) и VI.53.2.2. «Нейрогеномика психоповеденческих нарушений» (Дыгало Н.Н.). 2.1. Изучение генетико-молекулярных механизмов каталепсии мышей как новой модели наследственной предрасположенности к депрессии. 2.2. Исследование влияния полиморфизма C1473G в гене ключевого фермента биосинтеза серотонина, триптофангидроксилазы 2 (ТПГ2) на поведение и чувствительность к антидепрессантам у мышей. 2.3. Изучение влияния нокаута гена Kaiso на поведение и центральную нервную систему мышей. 2.4. Изучение влияния нокаута гена TNFα на поведение и центральную нервную систему мышей (начато).
3. При наличии прикладных результатов (что желательно) должен быть введен еще один раздел «Прикладные разработки». Прикладных разработок нет.
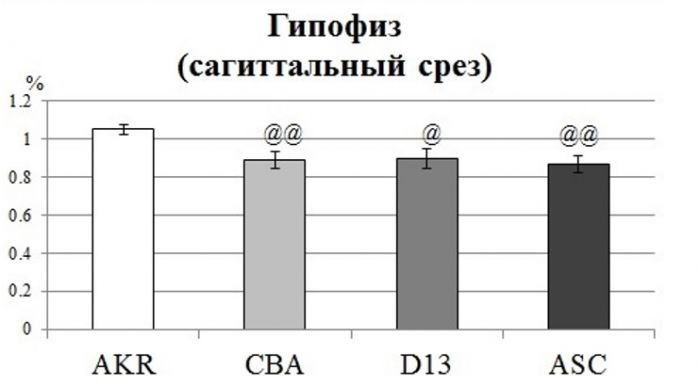
4. Иллюстрированное описание лучших результатов, полученных подразделением за последние 5 лет Изучение генетико-молекулярных механизмов каталепсии мышей как новой модели наследственной предрасположенности к депрессии. Каталепсия (животный гипноз, мнимая смерть, тоническая неподвижность) проявляется как длительная неподвижность. У человека каталепсия входит в кататонический синдром, который наблюдается при сильных нарушениях нервной системы. Ранее мы показали, что у половины мышей линии CBA/Lac выраженную реакцию замирания можно вызвать с помощью щипков кожи загривка. В то же время, у мышей большинства стандартных линий таких как C57BL/6, AKR, DBA/2 и др. вызвать каталепсию нельзя. Высокая предрасположенность к каталепсии у мышей CBA наследуется как рецессивный признак (Kulikov et al., 1993). Далее было показано, что главный ген каталепсии, определяющий 20% генетической изменчивости признака, локализован во фрагменте 106-116 т.п.о. хромосомы 13 мыши (Куликов и др., 2003; Куликов, Базовкина, 2003; Kulikov et al., 2008). Этот фрагмент был перенесен в геном устойчивой к каталепсии линии AKR и была создана рекомбинантная линия AKR.CBA-D13Mit76 (D13) (Kulikov et al., 2008). Кроме того с помощью длительной селекции на высокую предрасположенность к каталепсии была создана линия ASC (Antidepressant Sensitive Catalepsy) с выраженными депрессивно-подобными чертами (Базовкина и др., 2005; Альперина и др., 2007; Лисачев и др., 2008; Дубровина и др., 2008). Более того, наследственная каталепсия у мышей ASC подавляется хроническим, но не острым введением антидепрессантов (Тихонова и др., 2006; 2009; 2010). Поэтому, мыши с наследственной каталепсией CBA, D13 и ASC были предложены как модели для изучения некоторых наследственных механизмов депрессивных расстройств. Полагают, что одной из причин депрессивных расстройств может быть нейродегенерация, которая может проявляться в уменьшении размера некоторых структур мозга. С помощью МРТ было показано значительное уменьшение размера гипофиза у мышей каталептических линий CBA, D13 и ASC по сравнению мышами устойчивой к каталепсии линии AKR (Рис.1). Этот результат является новым свидетельством того, что мыши с наследственной предрасположенностью к каталепсии являются моделью серьезных нарушений головного мозга.
Рисунок 1. Площадь сагиттального среза гипофиза (% по от ношению к общей площади сагиттального среза мозга) у мышей линий AKR, CBA, D13 и ASC. @p<0.05, @@p<0.01 vs AKR.
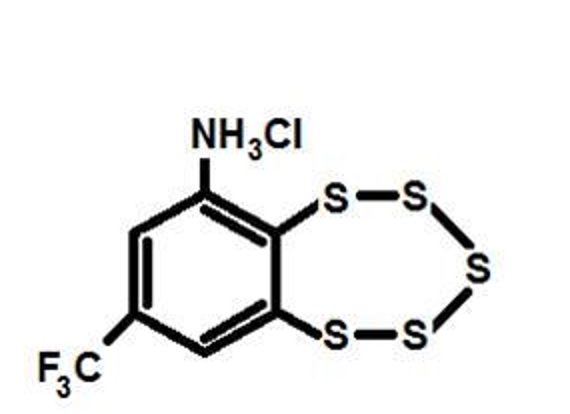
Выяснение механизма действия нового потенциального психотропного препарата 8-(трифторметил)-1,2,3,4,5-бензопентариепин-6-амина. Синтезированный в Новосибирском институте органической химии 8-(трифторметил)-1,2,3,4,5-бензопентариепин-6-амин гидрохлорид (ТХ-2153) (Рис.2) характеризуется чрезвычайно низкой острой токсичностью, проявляет выраженную противосудорожную активность (Khomenko et al., 2009). Для продвижения этого препарата на рынок необходимо было исследовать механизм его действия и выявить спектр возможных психопатологий, для лечения которых этот препарат может быть использован. Для этого мы использовали животных созданной нами патологической линии ASC с чрезвычайно высокой предрасположенностью к каталепсии (Kulikov et al., 2008) и чувствительной к антидепрессантам (Тихонова и др., 2006; 2009; 2010).
Рисунок 2. Химическая структура 8-(трифторметил)-1,2,3,4,5-бензопентариепин-6-амин. Показано, что хроническое введение 10 мг/кг ТХ-2153 в течение 16 дней подавляет наследственную каталепсию, увеличивает экспрессию BDNF в гиппокампе (Kulikov et al., 2012), а также подавляет экспрессию генов, кодирующих 5-HT1A рецептор серотонина, и МАОА – ключевого фермента разрушения серотонина – в среднем мозге (Куликов и др., 2011) мышей ASC (Таблица 1). Иными словами, эффект хронического введения ТХ-2153 на поведение и мозг сходен с таковым классических антидепрессантов. Таблица 1. Влияние хронического введения ТХ-2153 (10 мг/кг, per os, 16 дней) на выраженность каталепсии и экспрессию генов в головном мозге самцов мышей линии ASC.
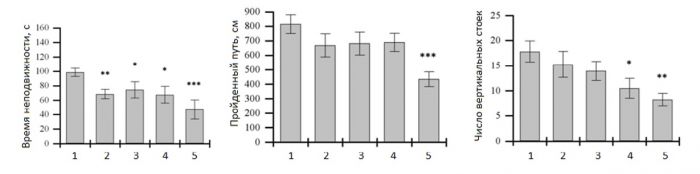
*уровень мРНК представлен числом транскриптов гена на 100 транскриптов RNA-polymerase 2. Для изучения антидепрессантной активности чаще всего используют тест принудительного плавания – все клинически эффективные антидепрессанты при остром введении снижают время «депрессивного» замирания в тесте принудительного плавания. Было установлено, что ТХ-2153 в дозе 20 мг/кг снижает время замирания в тесте принудительного плавания так же эффективно как и аналогичные дозы классических антидепрессантов, имипрамина и флуоксетина. Однако в отличие от классических антидепрессантов ТХ-2153 не оказывает негативных побочных эффектов, таких как снижение двигательной и исследовательской активностей в тесте открытого поля (Рис.3) (Kulikov et al., 2014). Таким образом, ТХ-2153 можно рассматривать как потенциальный антидепрессант нового поколения.
Рисунок 3. Влияние острого введения ТХ-2153, имипрамина и флуоксетина на время неподвижности в тесте принудительного плавания (с), пройденный путь (см) и число вертикальных стоек в тесте открытого поля у мышей линии AKR.CBA-D13Mit76. Все препараты вводили в per os. Поведение тестировали через 1 час после введения. 1-контроль, 2-ТХ-2153 (10 мг/кг), 3-ТХ-2153 (20 мг/кг), 4-флуоксетин (20 мг/кг), 5-имипрамин (20 мг/кг). *p<0.05, **p<0.01, ***p<0.001 vs контроль.
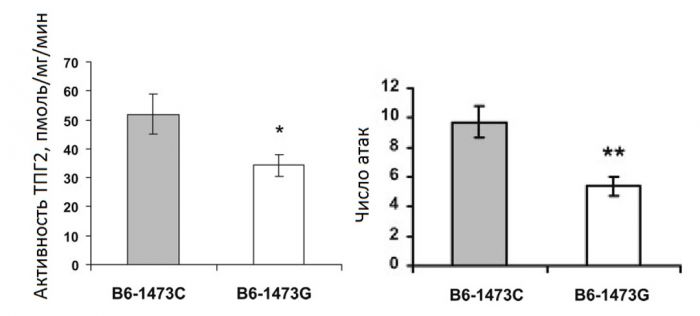
Исследование влияния полиморфизма C1473G в гене ключевого фермента биосинтеза серотонина, триптофангидроксилазы 2 (ТПГ2) на поведение и чувствительность к антидепрессантам у мышей. Полиморфизм C1473G приводит к замене пролина на аргинин в 447 позиции молекулы ТПГ2. Эта замена сопровождается резким снижением активности фермента (Zhang et al., 2004; Kulikov et al., 2005; Куликов и др., 2007; Osipova et al., 2009). Мы впервые показали, что в природе идет жесткий отбор против этой мутации и она не была обнаружении ни у одной из 75 исследованных диких мышей и у 39 новых линий, полученных от пойманных в природе диких мышей (Osipova et al., 2010). Влияние этой мутации на поведение не было исследовано. Ранее мы впервые показали, что мыши линий гомозиготных по G аллелю (низкая активность ТПГ2) проявляют меньшую агрессивность в межсамцовых контактах по сравнению с животными линий гомозиготных по С аллелю (дикий тип, высокая активность ТПГ2) (Kulikov et al., 2005). Для проверки гипотезы о сцеплении C1473G полиморфизма с выраженность межсамцовой агрессии у мышей впервые были получены две конгенные линии B6-1473C и B6-1473G. Мыши линии B6-1473C характеризовались высокой интенсивностью драк по сравнению с животными B6-1473G (Рис.4) (Osipova et al., 2009). Этот результат доказывает сцепление между C1473G полиморфизмом и выраженностью межсамцовой агрессии у мышей.
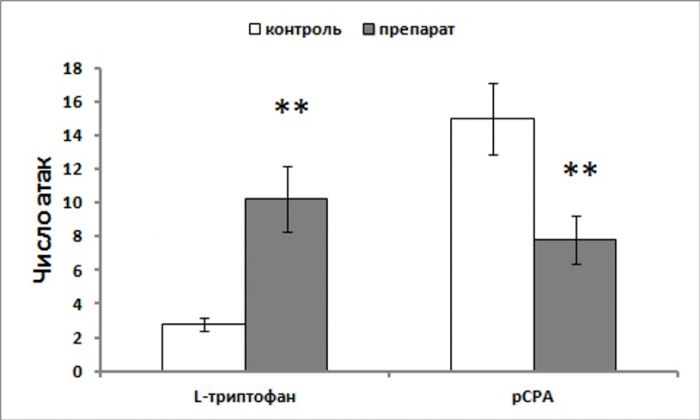
Рисунок 4. Активность ТПГ2 в среднем мозге (пмоль 5-гидрокситриптофана/мг белка/мин) и число драк у мышей линий B6-1473C и B6-1473G. *p<0.05, **p<0.01. Для проверки гипотезы, что это сцепление действительно является следствием вызванного мутацией снижения активности ТПГ2 был проведен фармакологический эксперимент, в котором активность ТПГ2 снижали у животных C57BL/6 необратимым ингибитором фермента pCPA (300 мг/кг, в течение 3 дней) или увеличивали у животных CC57Br введением предшественника – триптофана (300 мг/кг). Было установлено, что pCPA существенно снижал интенсивность драк к мышей C57BL/6, в то время как L-триптофан значительно увеличивал агрессию у мышей CC57Br (Рис.5) (Kulikov et al., 2012). Таким образом, впервые был выявлен путь от мутации C1473G в гене ТПГ2 к изменению выраженности межсамцовой агрессии мышей.
Рисунок 5. Число драк у мышей C57BL/6, получавших физиологический раствор или pCPA (300 мг/кг, в течение 3 дней) и мышей CC57Br, получавших L-триптофана (300 мг/кг). **p<0.01 vs контроль.
5. Задачи, планируемые на перспективу 5.1. Разработка научных принципов, подходов и критериев моделирования наследственных патологий человека на лабораторных животных. 5.2. Создание базы функциональных мутаций, ассоциированных с наследственными нервными и психическими патологиями человека, и их возможных «мышиных» аналогов и гомологов. 5.3. Создание коллекции генотипов мышей, несущих мутации, которые являются аналогами и гомологами распространенных в Сибири мутаций, ассоциированных с нарушениями нервной системы человека. 5.4. Изучение влияния мутаций и нокаута отдельных генов, экспрессирующихся в нервной системе, на поведение и нервную систему. 5.5. Изучение эпигенетических механизмов патологий нервной системы и поведения. 5.6. Выявление генетических механизмов чувствительности к психотропным препаратам. 5.7. Исследование механизмов действия новых отечественных фармакологических препаратов для лечения нервных и психических расстройств. Выберите слайдером нужный промежуток, и список ниже будет содержать записи только нужного периода: 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 |
||||||||||||||||||||||||||||
| © 2010-2026 ИЦиГ СО РАН. Все права защищены. |